干扰素基因刺激因子(STING)通路在抗肿瘤免疫的启动和“冷”肿瘤向“热”肿瘤的转化中起着至关重要的作用,是肿瘤免疫治疗的一个有希望的治疗靶点。然而,肿瘤细胞在应对cGAS-STING信号通路的激活时亦触发了其内部的保护性自噬。自噬的激活又会导致STING降解,对STING的激活起“刹车”作用以避免免疫过强。此外,自噬还可以减少应激反应,阻止ROS的积累,限制肿瘤细胞的相关损伤,促进肿瘤生长。
基于此,山东大学齐鲁医院于德新教授团队和山东大学化学与化工学院崔基炜教授团队合作搭建了一种包含锰离子、葡萄糖氧化酶(GOx)和自噬抑制剂羟基氯喹(HCQ)的可局部注射的水凝胶,通过多机制增强免疫用于防止三阴性乳腺癌术后复发和转移。水凝胶在术区持续释放Mn2+、GOx和HCQ,Mn2+进入肿瘤细胞内发挥STING激活作用,此外,在GOx的催化下,瘤内葡萄糖被氧化生成葡萄糖酸和H2O2,形成富H2O2的微环境。产生的H2O2被释放的Mn2+催化产生高毒性的?OH,杀死肿瘤细胞。释放的胞质DNA和线粒体DNA用于双向cGAS-STING通路的激活,刺激IFN-β分泌,以招募更多的效应T细胞至肿瘤微环境中。同时,HCQ抑制cGAS-STING通路的激活而产生的的保护性自噬,解除自噬对其的“刹车”作用,提升cGAS-STING通路激活而导致的免疫治疗效果(图1)。
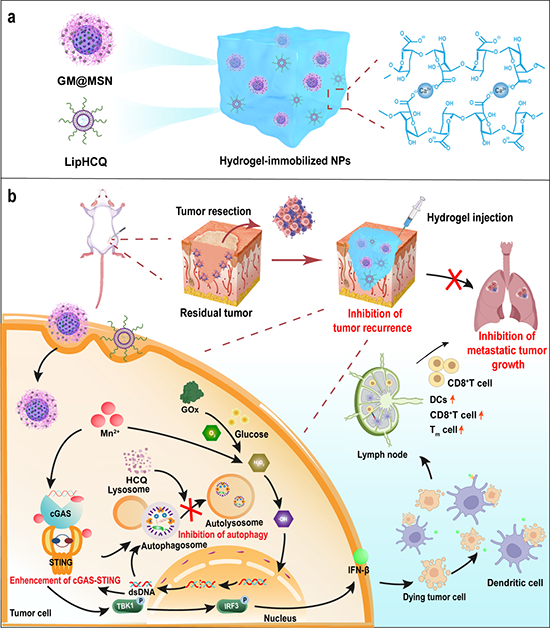
图1. 水凝胶包载纳米颗粒的合成及其免疫治疗示意图。
研究者以介孔硅为主要载体,基于静电相互作用实现了GOx的负载,基于金属-多酚配位化学实现了Mn2+的负载。采用脂质体纳米颗粒实现了HCQ的高效包封。瘤内葡萄糖在GOx的催化下产生葡萄糖酸和 H2O2。产生的 H2O2 在Mn2+存在时通过类芬顿反应产生高毒性的?OH,进而对肿瘤细胞起到很强的杀伤作用。将所制备纳米药物与海藻酸盐(ALG)溶液注入肿瘤术后部位,在Ca2+交联作用下,原位组装形成水凝胶包载纳米颗粒给药体系(图2)。

图 2. a) GM@MSN 纳米颗粒制备示意图; b) GM@MSN 制备的驱动力,包括配位相互作用、疏水相互作用和氢键; c) GM@MSN 的 TEM 图像和 EDX 图谱; d) MSN、MSN-NH2、M@MSN 和 GM@MSN 的 Zeta 电位; e) GOx 催化的葡萄糖和 Fenton 类反应示意图。
通过Western实验检测了STING、TBK1、IRF3、P-STING (Ser366)、P-TBK1 (Ser172)和P-IRF3 (Ser396)的表达,反映了GM@MSN联合LipHCQ对STING通路的激活作用。ELISA实验证实了CDT结合Mn2+可放大STING信号,诱导4T1细胞释放更多干扰素和炎症因子。为了更好地理解 STING 的激活作用,研究者还对治疗后的自噬水平进行了研究。通过Western 实验评估了 LC3B-II 和 p62的表达。与PBS组和GM@MSN组相比,LipHCQ处理细胞中的LC3B-II和p62蛋白明显增加,表明自噬抑制导致细胞内自噬体大量产生。此外,GM@MSN处理的细胞中p62蛋白下调,这可能是由于STING通路的激活导致了保护性自噬。重要的是,H/GM@MSN组的LC3B-II和p62表达量高于其他组,表明内部保护性自噬过程在很大程度上受到抑制。这一途径的阻断应有利于氧化损伤的增强和dsDNA的积累,从而进一步放大STING途径(图3)。

图 3. a) STING 通路激活示意图;b) 用 PBS、LipHCQ、M@MSN、GM@MSN 或 H/GM@MSN 培养 4T1 细胞后,STING 通路蛋白的 Western 印迹分析。Elisa分析c) IFN-β、d) TNF-α、e) IL-6 的分泌;f) HCQ 增强 STING 通路示意图;g) 不同 NPs 培养 24 小时后 4T1 细胞中自噬指示蛋白(即 LC3B 和 SQSTM1/p62)的表达; h) 不同处理 24 小时后 4T1 细胞中自噬小体的电镜图像。
在术后4T1荷瘤小鼠上评估了对肿瘤复发的抑制作用。与其他组相比,H/GM@Gel组能很好地控制了肿瘤的复发和生长。为了进一步探索该纳米体系对转移瘤是否有治疗效果,该团队又建立了小鼠肺转移肿瘤模型。PBS、H@Gel和M@Gel组处理的小鼠的肺组织具有明显的乳腺癌转移灶。相反,在H/GM@Gel 组随访时间内观察到少量肺转移灶的出现,这表明H/GM@Gel 可以有效抑制转移性肿瘤细胞的生长(图4)。

图 4. a) 抑制肿瘤复发的免疫疗法示意图;b) 治疗期间小鼠体重的变化;c) PBS、H@Gel、M@Gel、GM@Gel 和 H/GM@Gel (GOx:3 mg/kg;HCQ:10 mg/kg)治疗后肿瘤体积的变化 d) 和肿瘤重量的变化;e) 不同治疗后复发肿瘤的照片;f) 不同治疗后复发肿瘤组织的 H&E 和 Ki67 染色图像;g) 抑制肺转移瘤的免疫疗法示意图;h) 不同治疗后小鼠的生存曲线; i) 肺转移瘤图片;j) 肺转移瘤定量分析;k) 不同治疗后转移性肺结节的 H&E 染色。
为了证明自噬抑制可以增强STING通路激活引起的抗肿瘤免疫,研究者测定了肿瘤内免疫细胞的浸润。与其他组相比,H/GM@Gel 组诱导辅助T淋巴细胞(CD3+D4+)和细胞毒性T细胞(CD3+CD8+)的比例最高。这是由于CDT显著增强Mn2+的STING通路激活加之HCQ解除对STING通路的“刹车”,释放较多IFN-β及促炎因子刺激DC成熟以招募更多细胞毒性T细胞的结果。同时,相对于所有治疗组,H/GM@Gel 组诱导的成熟DC数量也是最多的。此外,与PBS组相比,H/GM@Gel组可显著降低MDSC和Tregs的比例。研究者进一步分析了TME内效应记忆细胞的比值,结果显示H/GM@Gel治疗组产生的TEM水平是PBS治疗组的2.37倍。这些结果进一步表明,H/GM@Gel可以有效地增强抗肿瘤免疫应答,并诱导长期免疫记忆效应,预防肿瘤复发和转移。
总的来说,本工作设计了一个由水凝胶包载的H/GM@Gel治疗平台,该体系可持续释放GOx和Mn2+,通过CDT在肿瘤细胞中有效地产生ROS,释放大量胞质dsDNA和线粒体dsDNA,从而与Mn2+结合加速和放大STING通路的激活,增强先天免疫。此外,由于STING通路的激活而产生的保护性自噬被HCQ切断,可进一步扩大了STING通路激活产生的抗肿瘤免疫反应。同时,CDT可有效诱导ICD,释放肿瘤细胞抗原,刺激DC成熟并招募更多的T细胞进一步杀伤肿瘤。通过这两种作用的协同,H/GM@Gel已被证明在肿瘤中具有优越的STING通路激活作用。由于STING通路的激活,有效的I型IFN应答和抗原特异性T细胞应答被激活,从而对术后肿瘤的复发和转移产生显著的抑制作用。综上所述,H/GM@Gel在4T1荷瘤小鼠模型中显示出有效的肿瘤生长抑制作用,在促进抗肿瘤免疫治疗方面具有潜在的临床应用价值。
原文链接:https://doi.org/10.1016/j.cej.2023.148211
- 广东省科学院郭会龙/广州红会医院于锋、林颖 MTB:微环境调控可注射水凝胶在中耳-乳突炎性缺损修复领域的新应用 2025-05-17
- 西南医大口腔医院陶刚/黎春晖/蔡蕊团队:具有ROS触发药物释放特性的可注射水凝胶实现抗菌剂和抗炎纳米颗粒协同递送用于牙周炎治疗 2025-04-15
- 吉林大学刘镇宁教授/王冰迪博士团队 Adv. Sci.:亚精胺功能化可注射水凝胶减轻炎症反应,促进急性和糖尿病伤口愈合 2024-04-17
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
