南京大学甄叙、蒋锡群团队《Adv. Mater.》: 光控自富集的仿生半导体聚合物纳米材料用于精准肿瘤血管损伤治疗
肿瘤血管损伤治疗在临床实践中为肿瘤的治疗提供了新的手段,然而血管损伤试剂(Vascular Disrupting Agents,VDAs)的脱靶效应和潜在的高剂量毒性限制了其在临床应用中的治疗效果。为了解决以上问题,南京大学甄叙、蒋锡群研究团队报道了一种不含VDA的仿生半导体共轭聚合物纳米材料(SPNP)通过两次激光照射实现了较低剂量下的精准破坏肿瘤血管,从而达到优异的抗肿瘤效果。
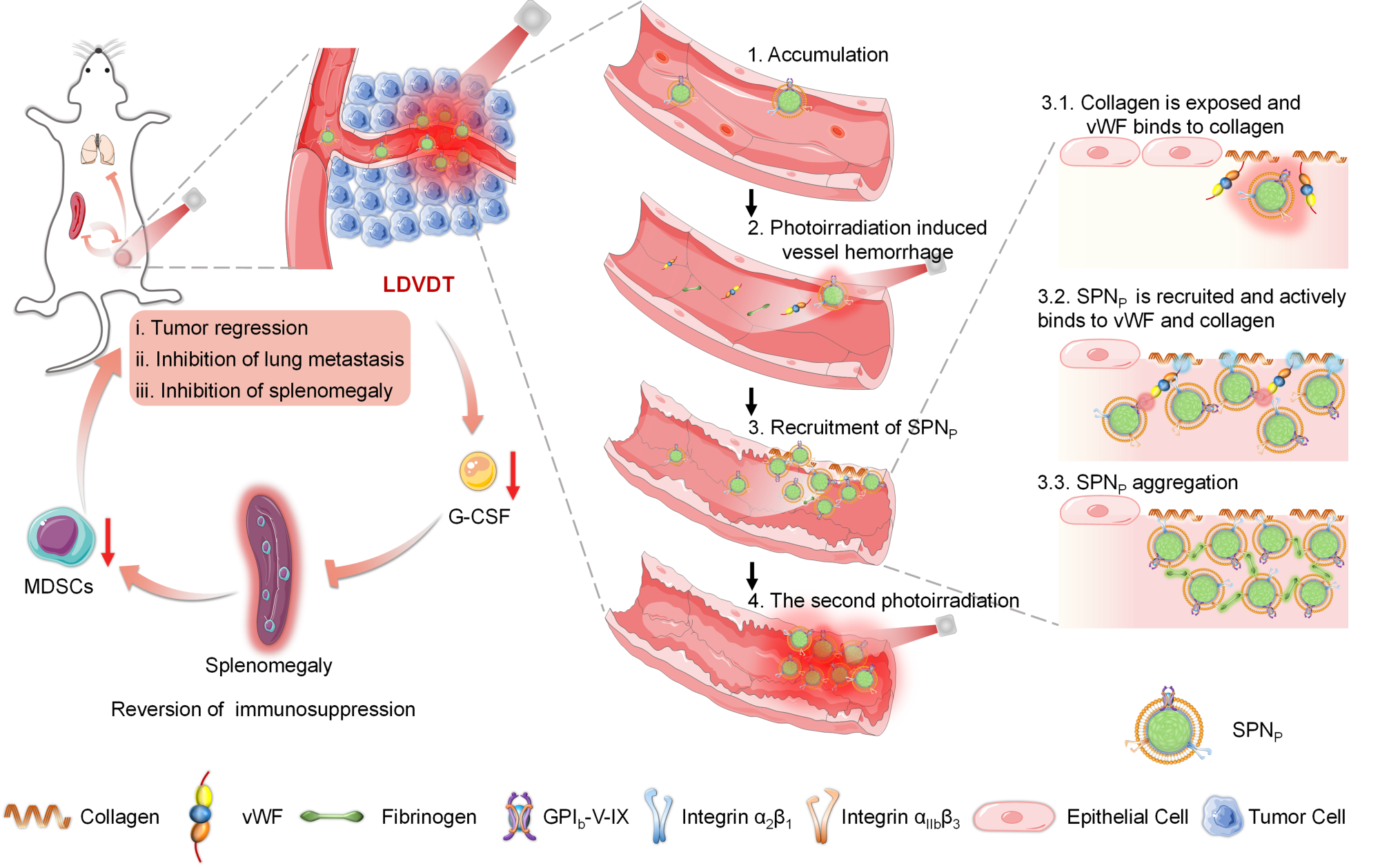
图1. SPNP通过两段光控进行精准肿瘤血管损伤治疗机制示意图。
SPNP由具有高光热转换性能的semiconducting polymer nanoparticles (SPN)内核和具有靶向破损血管功能的血小板膜外壳组成。如图1所示,光控血管靶向损伤治疗(Light-driven Vascular Targeting and Disruption Therapy,LDVDT)通过四个步骤级联进行。在全身性给药4小时后,SPNP通过EPR效应富集到肿瘤区域,并因为时间原因处于血管周围并未渗透到肿瘤内部(步骤1);在此时间点,SPNP产生的温和高温会导致肿瘤血管破损并出血(步骤2);破损的血管会激活凝血级联反应,自主招募血液循环中的血小板以及包覆了血小板膜的SPNP特异性富集于受伤的肿瘤血管(步骤3)。血管处自主聚集的SPNP可以显著提高第二次激光照射的光热效果,产生高温对肿瘤血管进行精准破坏(步骤4),从而有效杀伤实体肿瘤,抑制肺转移及脾肿大,并逆转肿瘤免疫抑制微环境。

图2. 光控SPNP肿瘤血管自募集行为的机理研究。
作者使用双侧肿瘤模型小鼠验证SPNP的自增强损伤血管靶向能力,在全身给药4小时后对右侧肿瘤细胞进行第一次激光照射导致肿瘤血管损伤,左侧肿瘤不做处理,小动物活体成像结果显示在给药后24小时SPNP在肿瘤中的富集量达到最大值,且SPNP在血管受损的肿瘤中的富集量是未处理肿瘤中的1.4倍,表明SPNP可以自主富集靶向到受损的肿瘤血管。通过凝血相关生物标志物的免疫荧光染色对这种自增强富集行为的机理进行验证表明,肿瘤血管出血损伤导致凝血级联反应激活,外周血中的vWF与受损肿瘤血管结合,募集外周血中的SPNP向损伤血管聚集,随后纤维蛋白原在损伤部位水解为纤维蛋白对聚集的SPNP进行固定。进一步对肿瘤组织切片中SPNP与血管的空间位置进行分析,结果显示自增强富集的SPNP主要分布在肿瘤血管周围,表明SPNP可以通过凝血级联过程靶向富集到受损的肿瘤血管。

图3. (A)4T1荷瘤小鼠在光照时的平均肿瘤温度。(B)经过不同处理后肿瘤的生长曲线。(C)不同处理20天后肿瘤部位的Caspase-3免疫荧光染色。(D-H)不同处理后血管相关生物标志物的染色图片和定量分析。
基于SPNP自主靶向受损肿瘤血管的能力,作者使用4T1荷瘤小鼠对基于LDVDT策略的肿瘤血管疗法效果进行评估,在注射SPNP 4小时后进行第一次激光照射,在给药后24小时对肿瘤进行第二次激光照射,由于SPNP自主靶向受损肿瘤血管的能力,使得在给药24小时后肿瘤富集能力达到最大,显著提高第二次激光照射的光热效果,产生高温对肿瘤血管进行精准损伤,实现了优异的抗肿瘤效果。通过对肿瘤组织中的血管相关生物标志物进行免疫组化和免疫荧光染色实验表明LDVDT策略可以完全破坏肿瘤血管,并有效抑制血管生成和粘附相关分子VEGF和VCAM-1的表达。

图4. 光控血管靶向损伤疗法抑制脾肿大和逆转免疫抑制肿瘤微环境
在实验中,发现LDVDT策略可以显著抑制了脾肿大现象的发生,治疗后的小鼠脾脏重量与健康小鼠相近,但显著低于发生其他对照组小鼠。对不同处理小鼠的脾脏进行H&E组织切片发现LDVDT显著抑制了脾肿大小鼠脾脏的红髓增生现象。有研究表明,脾脏红髓增生代表髓外造血的发生。作者进一步对此现象可能的机制进行了研究,通过评估小鼠外周血中的红细胞生成素(Erythrocytes,EPO)、血小板生成(Thrombopoietin,TPO)和粒细胞集落刺激因子(Granulocyte Colony-stimulating factor,G-CSF)的表达水平,发现各组小鼠红细胞生成素和血小板生成素在外周血中的表达水平没有变化,而荷瘤小鼠外周血中G-CSF的浓度在经过LDVDT策略治疗后显著降低,且与健康小鼠表达水平一致,表明肿瘤来源的G-CSF可能是导致髓外造血和脾肿大现象的关键因子。G-CSF可以诱导髓系细胞向免疫抑制和促进肿瘤功能的表型扩增和分化。对不同处理小鼠脾脏和肿瘤中的MDSCs进行分析可知LDVDT策略显著降低了脾脏和肿瘤中MDSCs细胞的数量。为了进一步验证LDVDT策略对肿瘤免疫抑制肿瘤微环境的逆转作用,作者通过免疫荧光染色分析免疫抑制肿瘤微环境生物标志物精氨酸酶1和诱导型一氧化氮合酶在肿瘤组织中的表达水平,相比于其他治疗,LDVDT策略显著降低了肿瘤中ARG1和iNOS的表达量。表明SPNP介导的LDVDT策略有效逆转了免疫抑制的肿瘤微环境,为探索肿瘤血管损伤治疗开辟了新的免疫治疗方向。
该研究成果以“Light-driven self-recruitment of biomimetic semiconducting polymer nanoparticles for precise tumor vascular disruption”为题发表在Advanced Materials。论文第一作者为南京大学博士生李昊泽,通讯作者为南京大学甄叙研究员和蒋锡群教授。斯坦福大学姜语嫣助理研究员在本工作的实验结果讨论、文章修改方面给予了大力支持与帮助。本研究工作得到国家重点研发计划,国家自然科学基金,中央高校基本科研基金等项目资助。
原文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.202210920




