青岛大学丛海林/胡浩团队《Carbohyd. Polym.》:壳聚糖衍生物交联水凝胶 - 控制释放多聚脱氧核苷酸用于伤口治疗
2022-11-20 来源:高分子科技
核酸作为一种生物活性物质,可直接作用于致病的靶基因或mRNA,在基因水平发挥作用,具有特异性高、效率高、作用时间长等明显优势。基因治疗已被广泛研究用于多种疾病,如癌症、病毒感染、遗传性疾病等的治疗。在创面修复应用中,由于损伤部位周围功能细胞和生长因子表达的紊乱,基因递送显示出了可行性。但由于核酸的易降解性,在伤口治疗中缺乏有效的给药途径,设计智能水凝胶实现核酸的时空可控输送,对临床应用具有重要意义。
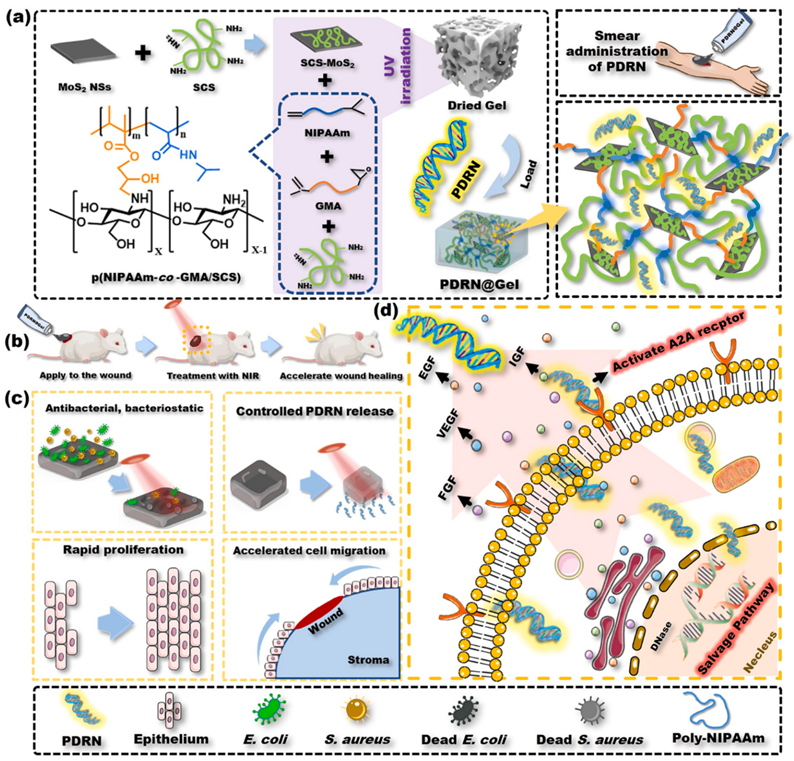
图1. 复合水凝胶的制备及应用示意图
为了提高MoS2的生物相容性和聚合物溶液的均一性,作者首先对其作了SCS改性。作者确定了NIPAAm与SCS的混合比例以平衡共聚物的低临界溶解温度(LCST)与水凝胶的力学性能的关系。如图2所示,水凝胶的宏观状态随温度变化。水凝胶的储存模量(G’)远大于损耗模量(G”),验证了水凝胶的弹性状态。SEM表征了水凝胶典型的三维网络结构,能量色散光谱也表明了水凝胶组分的均匀性。干燥的凝胶在吸收PDRN溶液后变得柔软和流动。作者使用注射装置验证了水凝胶的可注射性和流动性。此外,水凝胶还能很好地黏附在手指关节表面。

图2. 水凝胶的物理性能表征
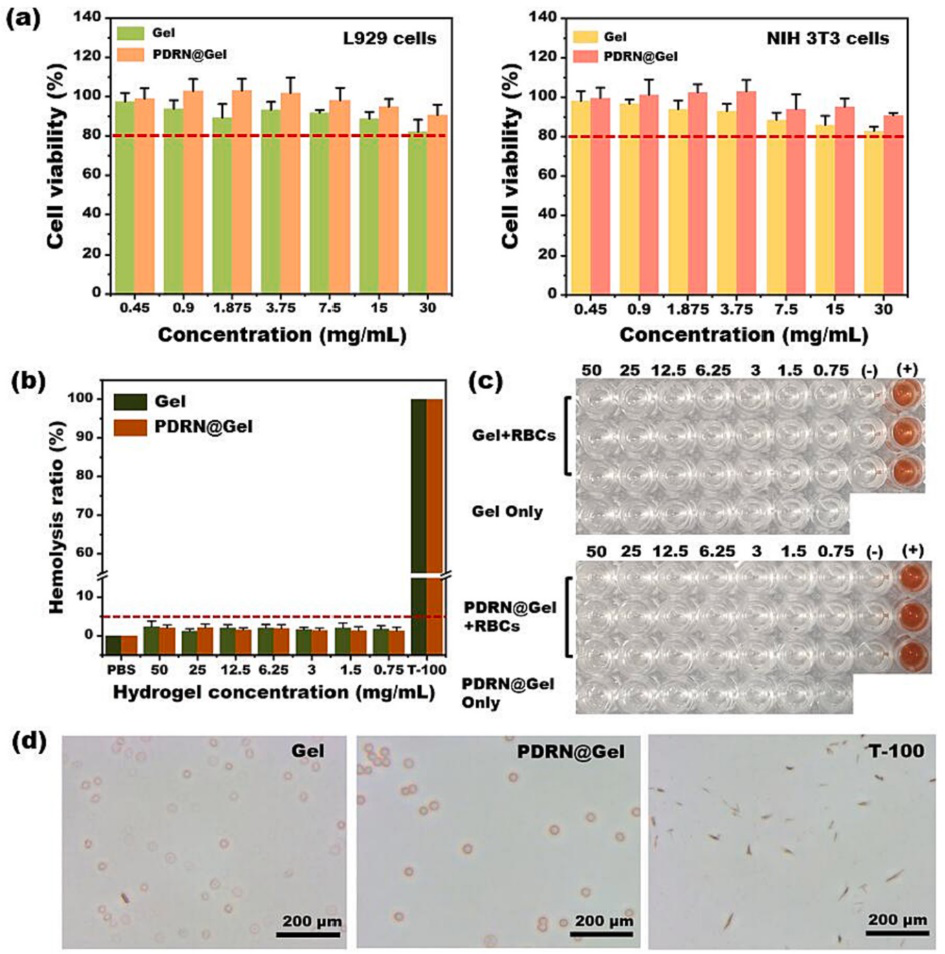
图3. 水凝胶的生物相容性表征
随后,作者利用弗朗茨扩散池(Franz)模拟了水凝胶在创面的真实药物释放行为(图4)。结果显示,在近红外照射下,水凝胶中的MoS2迅速实现光热转换,促使凝胶网络快速释放PDRN。作者随后又探究了照射时间与药物释放之间的关系,并确定了最佳辐照时间,以保证合适的药物释放。

图4. 水凝胶的药物控制释放探究
加速的细胞增殖和迁移有利于伤口的快速修复。如图5所示,作者验证了在体外近红外光的作用下,水凝胶对细胞增殖和迁移的促进效果,证明了该复合水凝胶作为伤口敷料用于核酸类药物控释的有效性。
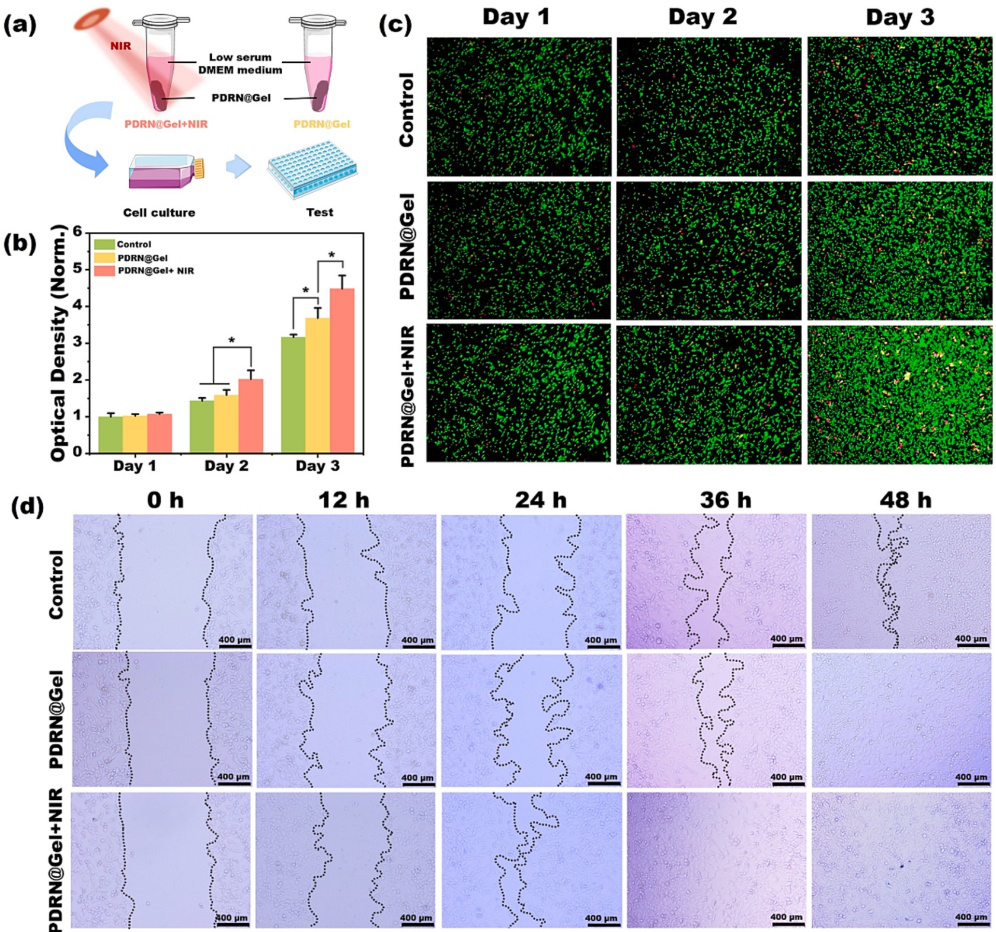
图5. 水凝胶的促细胞增殖和迁移测试
如图6所示,作者使用小鼠全层皮肤创面模型评价了水凝胶的治疗效果,联合治疗组的小鼠表现出更快的伤口愈合。第2天创面收缩率超过20%,明显高于其他组。作者还表征了创面愈合过程中伤口部位细胞因子的变化,结果显示水凝胶能够加快创面部位血管形成并具有抗炎作用。在组织学分析中,实验组的创面表现出了高质量的创面愈合效果。

图6. 小鼠全层皮肤创面模型评价水凝胶的治疗效果
总体而言,作者制备了一种纳米复合水凝胶,在近红外光的远程刺激下,可实现PDRN的“时空可控”释放,打破了以核酸为基础的药物在皮肤管理中容易降解和难以递送的困境。纳米复合水凝胶具有使用方便、黏附性好、抗菌性能增强等优点,提高了创面愈合效率,促进了皮肤缺损修复过程中的毛囊、皮肤附属器、胶原蛋白以及细胞因子等的增加。作者提出的水凝胶模型为基因治疗在创面治疗中的应用提供了解决方案。
原文链接:https://doi.org/10.1016/j.carbpol.2022.120298
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 南科大刘吉团队 AFM:仿生矿化微球增韧抗冲击纳米复合水凝胶 2025-07-31
- 上海市第一人民医院马小军/东华大学何创龙 Bioact. Mater.:TME响应复合水凝胶靶向抑制MYC驱动型骨肉瘤生长与转移 2025-01-17
- 西电王忠良教授团队 Adv. Sci.:焦亡之光 - 突破乳腺癌术后复发的新希望 2024-11-13
- 中山大学肿瘤医院杨江教授 JCR:可吸入式pH响应型电荷反转聚合物-siRNA复合物用于ALK融合阳性肺癌靶向基因治疗 2025-03-31
- 天津大学仰大勇团队 Sci Adv:DNA纳米材料可控组装赋能肿瘤基因治疗 2023-09-04
- 国家纳米科学中心孟幻团队《Nano Today》:纳米白介素-10基因免疫治疗促进肌肉修复 2022-07-25
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
