基于单克隆抗体(mAbs)的癌症免疫疗法,包括免疫检查点阻断(ICB)和免疫刺激疗法,是一种强大的癌症治疗策略。尽管取得了各种成功,但严重的副作用,如脱靶效应引起的一系列免疫相关不良事件(irAEs),酶降解引起的快速清除,以及免疫原性和与Fc-γ受体(FcγRs)的非特异性结合仍然是实现mAbs的全部潜力的巨大挑战。因此,各种纳米给药系统已经被研究来克服基于mAbs的癌症免疫疗法的局限性并提高其疗效,根据货物装载方法,这些纳米给药系统可分为两类,通过非共价相互作用装载mAbs的物理封装给药系统和通过共价化学键装载mAbs的化学结合给药系统。前者通常将mAbs装入纳米给药系统的内部空间,从而保护mAbs免受酶降解、非特异性结合和免疫毒性引起的脱靶效应。后者一般将mAbs负载在纳米粒子表面,可以时空传递多种类型的mAbs,实现多途径靶向。然而,在某种程度上,纳米粒子表面的暴露型mAbs也面临着与游离型mAbs相同的局限性。因此,迫切需要能够协同和时空传递多种类型的mAbs的纳米平台,同时能够克服游离型或暴露型mAbs的局限。受天然保持酶/折叠酶(holdase/foldase)分子伴侣的工作机制和功能的启发,他们注意到holdase的功能(屏蔽折叠蛋白的激活和降解)对于降低mAbs的免疫毒性和延长半衰期;foldase的功能(帮助非天然蛋白在适当的时间正确折叠)对于mAbs在体内的目标部位发挥作用是可取的。
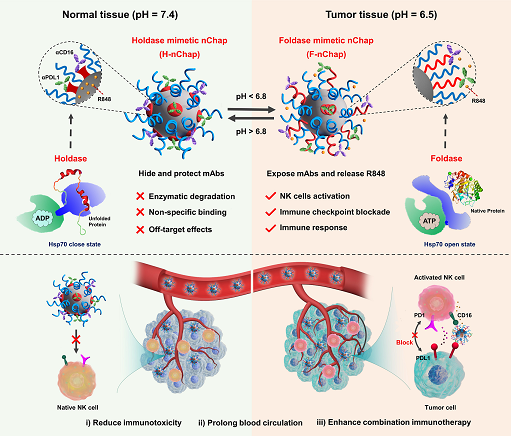
图1. H/F-nChap改善基于抗体的癌症免疫疗法的示意图。
研究人员首先以自组装的方法制备了H/F-nChap(图2a),在不同的pH条件下,PAE链的去质子化/质子化所引起的可逆的疏水/亲水转化使MSPM具有holdase/foldase般的活性。动态光散射(DLS)和静态光散射(SLS)的测定证实了MSPM对mAbs的隐藏/暴露效果(图2b, c)。ELISA测定的不同条件下mAbs的Fc结构域的浓度,与蛋白酶K(PK)孵育后的降解情况,以及pH 7.4条件下抗原抗体亲和力的变化证明了H/F-nChap的holdase活性,将mAbs隐藏在疏水性微域中能够保护mAbs,有效抑制mAbs的脱靶作用和被蛋白酶降解(图2d-f)。接下来,H/F-nChap的foldase作用通过测量在pH 6.5时抗原抗体亲和力,共聚焦显微镜和流式细胞仪分析进行研究,结果证明H/F-nChap可以响应pH值的变化而将mAbs暴露从而恢复mAbs的抗原结合活性(图g-j)。
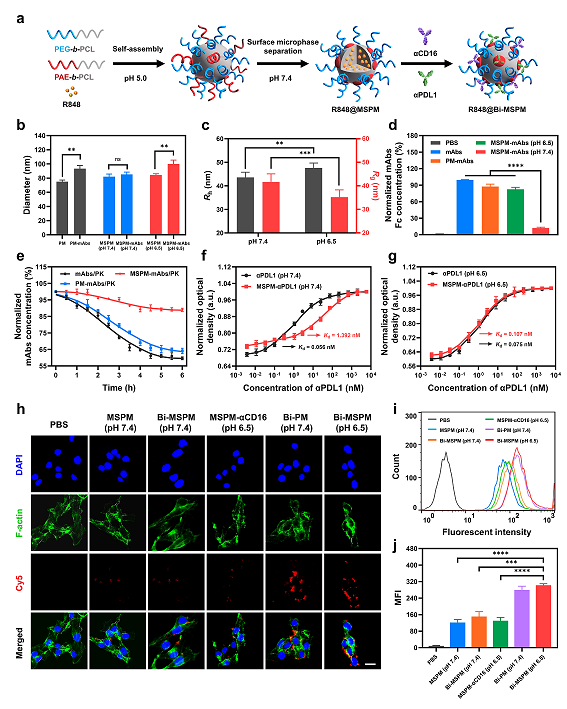
图2. H/F-nChap在体外对mAbs的隐藏和暴露作用。

图3. H/F-nChap的体内药代动力学和抗肿瘤效率分析。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/smtd.202201051
- 温州医科大学沈贤/南开大学齐迹 AFM:纳米催化剂协同放大增强AIEgen的光诊疗性能用于癌症免疫治疗 2024-02-22
- 饶浪/陈小元/黄鹏 ACS Nano:生物材料助力免疫检查点治疗 2023-02-12
- 南开史林启教授/天工大马飞贺研究员《Mater. Horiz.》综述:基于聚合物纳米颗粒的纳米疫苗用于癌症免疫治疗 2022-12-03
- 南开大学史林启教授团队和中国医学科学院刘鉴峰研究员团队合作:模拟热休克蛋白介导的免疫过程增强肿瘤免疫治疗 2020-05-27
- 南开大学史林启教授、马如江副研究员团队:纳米分子伴侣调控胰岛素的递送 2020-02-25
- 新型纳米分子伴侣重塑β-淀粉样蛋白稳态用于阿尔兹海默症的预防性治疗 2019-09-29
