葡萄糖代谢途径的改变是肿瘤代谢重编程的典型特征之一,其与肿瘤乏氧、微酸等微环境特征密切相关。肿瘤乏氧会进一步促进肿瘤细胞通过糖酵解途径获取能量,而乳酸等代谢产物的累积又会导致肿瘤微酸环境的形成,进而协同导致肿瘤免疫抑制性微环境的形成。这不但会促进肿瘤的发生、进展和转移,还会导致肿瘤对放疗、化疗、免疫治疗等多种治疗手段产生严重的耐受性。
近日,苏州大学刘庄教授和冯良珠研究员团队针对这一问题成功设计构建了一个兼具肿瘤乏氧与微酸调控功能的氟化碳酸钙基复合纳米药物,探索了其在调控肿瘤内葡萄糖代谢途径、逆转免疫抑制性微环境和增敏放疗疗效方面的潜力。作者首先通过配位反应将多巴胺修饰的全氟癸二酸分子(PFSEA-DA2)与金属铁离子(Fe3+)包覆在碳酸钙纳米颗粒表面,制备得到了一种多功能氟化碳酸钙纳米复合物(fCaCO3)。聚乙二醇表面修饰后,所得到的fCaCO3-PEG可高效负载全氟-15-冠醚(PFCE),进而作为一种有效的氧气递送载体与质子中和剂。研究表明,经静脉注射后,PFCE@fCaCO3-PEG不仅可以作为一种长循环的纳米氧气储存器,以减轻肿瘤缺氧,还可以通过抑制乳酸的产生并消耗细胞外质子,从而有效中和酸性肿瘤微环境。在不同免疫原性的肿瘤模型中,PFCE@fCaCO3-PEG均表现出显著的放射增敏效果。此外,PFCE@fCaCO3-PEG辅助放射疗法还可以通过改善肿瘤免疫抑制微环境,激活系统性抗肿瘤免疫反应,从而实现对远端肿瘤的有效抑制并有效防止肿瘤的复发(示意图)。

示意图 PFCE@fCaCO3-PEG 纳米调节器增强肿瘤放疗的机制图
实验结果方面,作者首先在全氟癸二酸(PFSEA)的两端共价偶联多巴胺分子来合成末端为邻苯二酚结构的PFSEA-DA2,之后以无定型碳酸钙纳米颗粒为模板,利用PFSEA-DA2与Fe3+之间的配位作用,通过表面保护性刻蚀法制备氟化碳酸钙纳米颗粒(fCaCO3),经表面PEG化修饰后物理吸附PFCE后得到了兼具高效的氧气负载能力以及质子中和能力PFCE@fCaCO3-PEG(图1)。
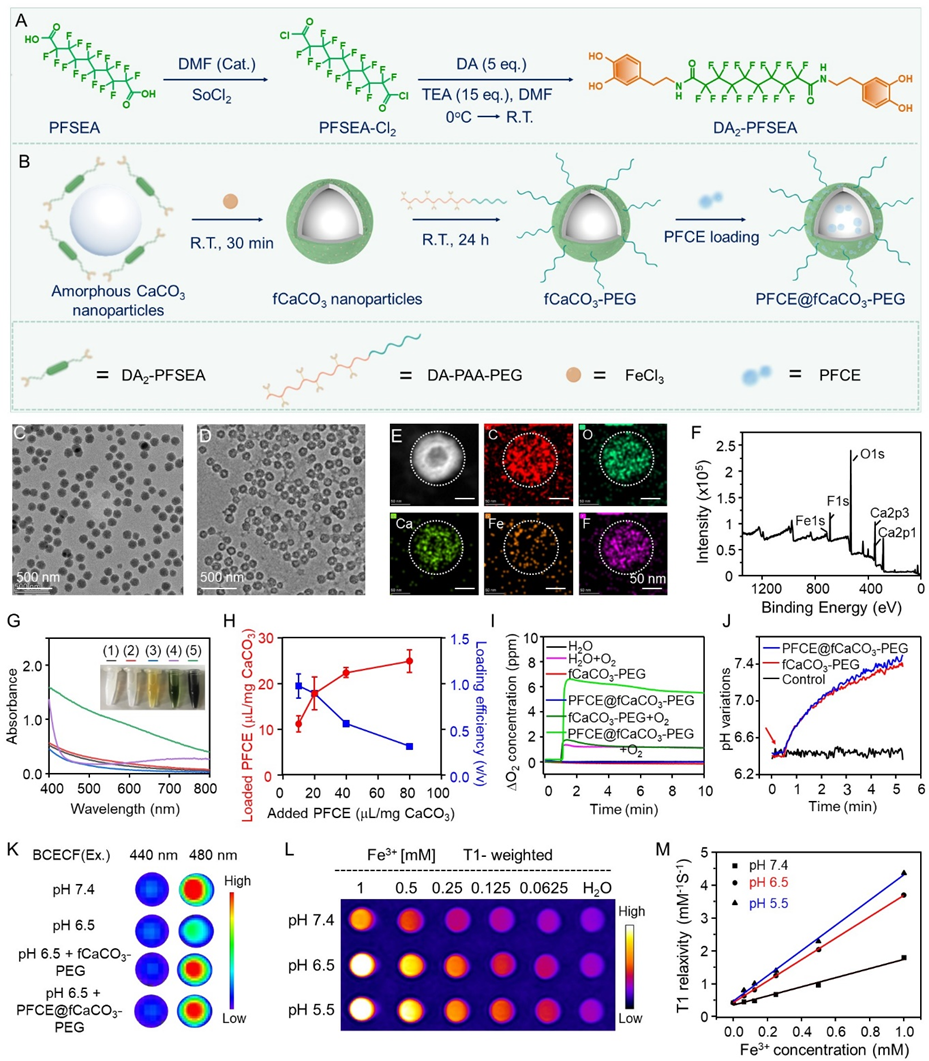
图1. PFCE@fCaCO3-PEG的合成与表征
细胞实验结果表明,负载氧气的PFCE@fCaCO3-PEG可以有效重塑低氧条件下CT26细胞的葡萄糖代谢,降低细胞低氧代谢中缺氧诱导因子1α(HIF-1α)、乳酸脱氢酶 A(LDHA)和碳酸酐酶IX(CAIX)的表达水平,进而降低胞内乳酸的产生,并最终显著逆转微酸和缺氧诱导的放射耐受性(图2)。

图2. PFCE@fCaCO3-PEG纳米反应器的放射增敏效果
通过建立小鼠肿瘤模型,作者发现PFCE@fCaCO3-PEG具有良好的药代动力学特征,可实现高效的肿瘤富集。与此同时,PFCE@fCaCO3-PEG可用于肿瘤的多模态成像(磁共振成像、光声成像)。随后,作者验证了PFCE@fCaCO3-PEG纳米调节器能够有效改善肿瘤乏氧,降低瘤内乳酸的产生,并中和酸性肿瘤微环境(图3)。

图3. PFCE@fCaCO3-PEG药代动力学与肿瘤微环境调控能力研究
进一步地,作者利用小鼠的皮下乳腺癌模型和结肠癌模型发现经静脉注射的PFCE@fCaCO3-PEG能够有效地增强放疗的疗效,并且对机体不会造成任何明显的不良反应(图4)。
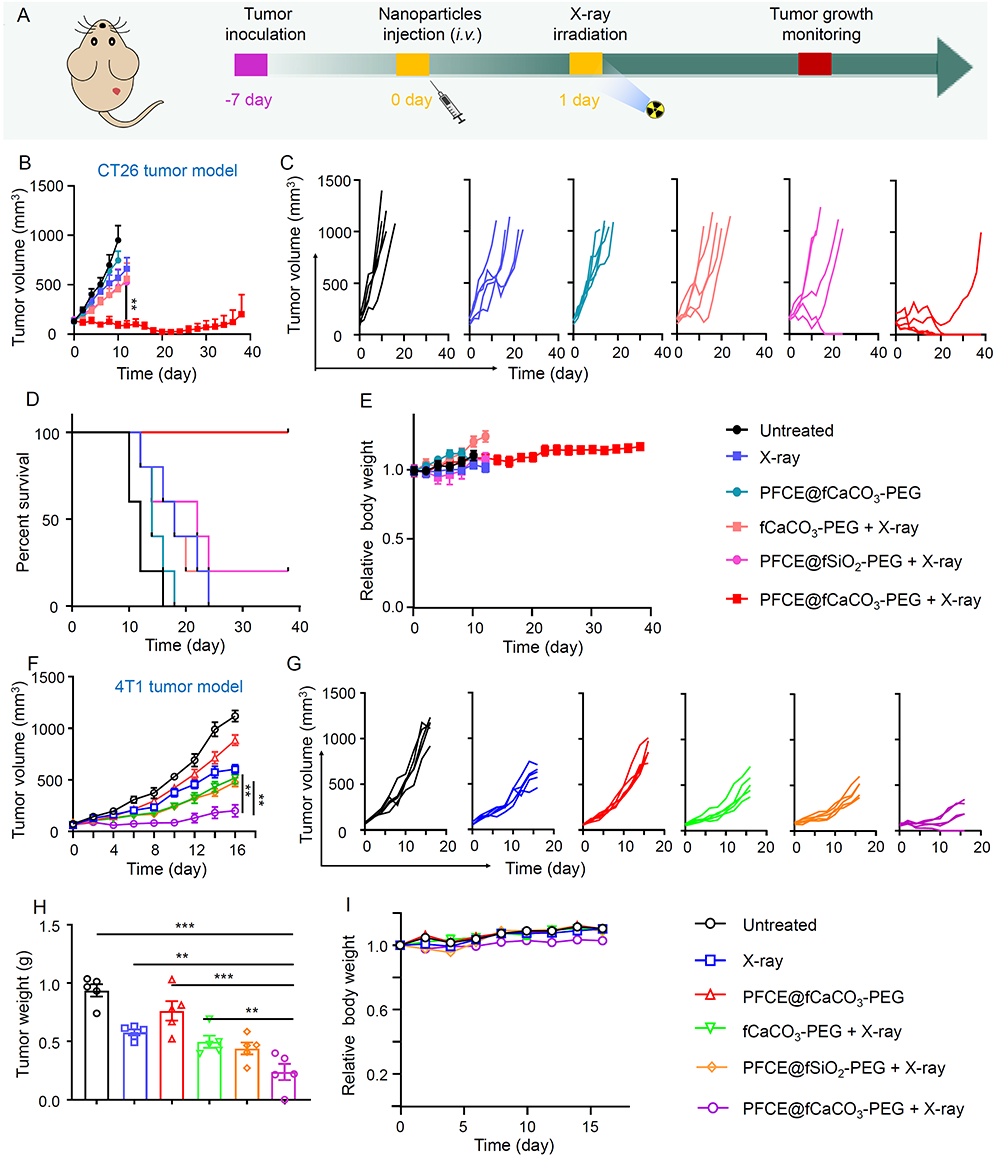
图4. PFCE@fCaCO3-PEG增敏放疗研究
通过对PFCE@fCaCO3-PEG增敏放疗的机制研究,作者发现PFCE@fCaCO3-PEG协同放射治疗,可以有效地逆转免疫抑制性肿瘤微环境,同时激活机体的固有性和获得性抗肿瘤免疫反应(图5)。
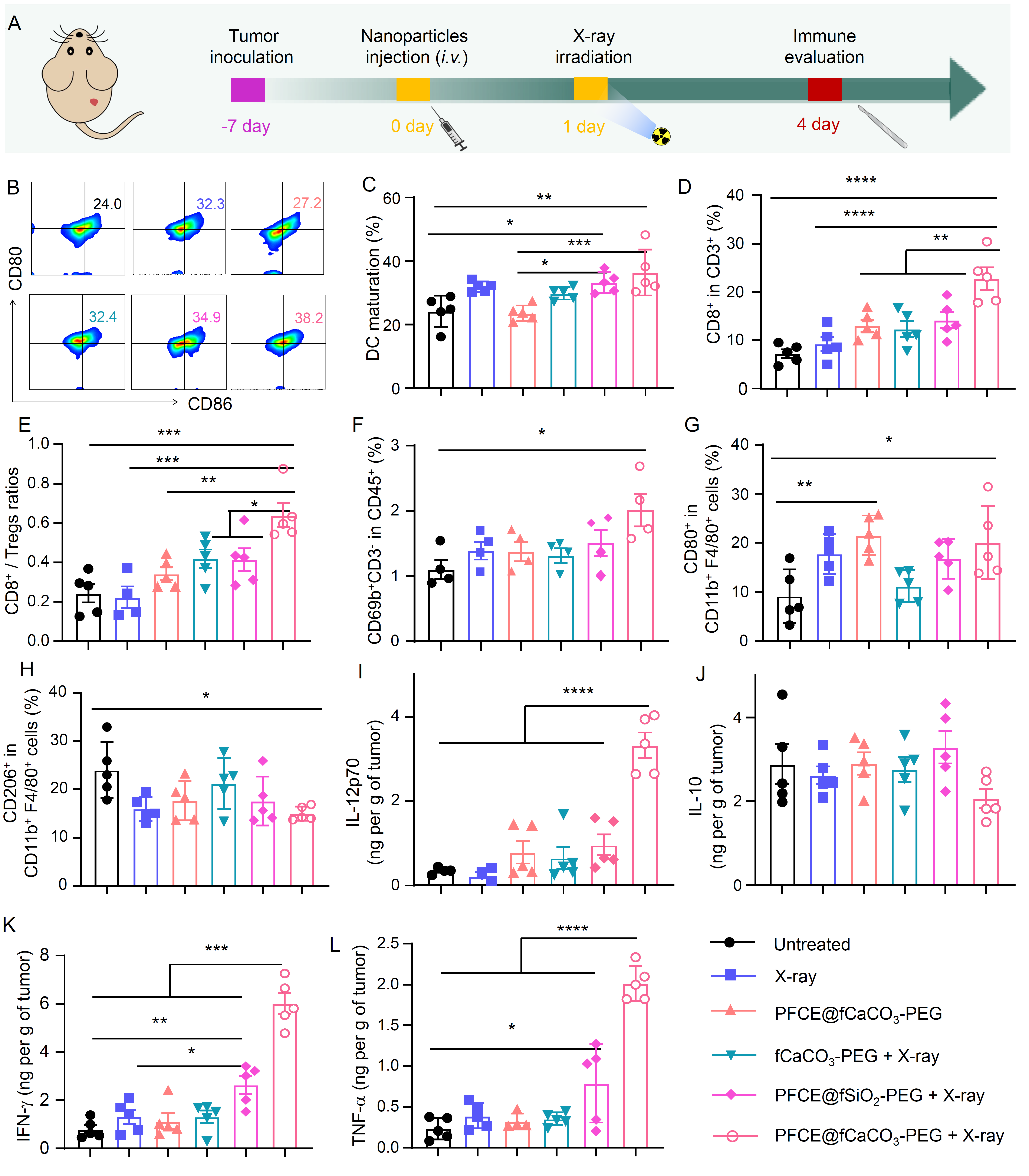
图5. PFCE@fCaCO3-PEG增敏放疗的免疫机制研究
最后,作者进一步验证了PFCE@fCaCO3-PEG协同放射治疗不仅可以通过远隔效应(abscopal effect)抑制远端未治疗肿瘤的生长,还可以通过引发长期的免疫记忆来抑制肿瘤的复发(图6)。
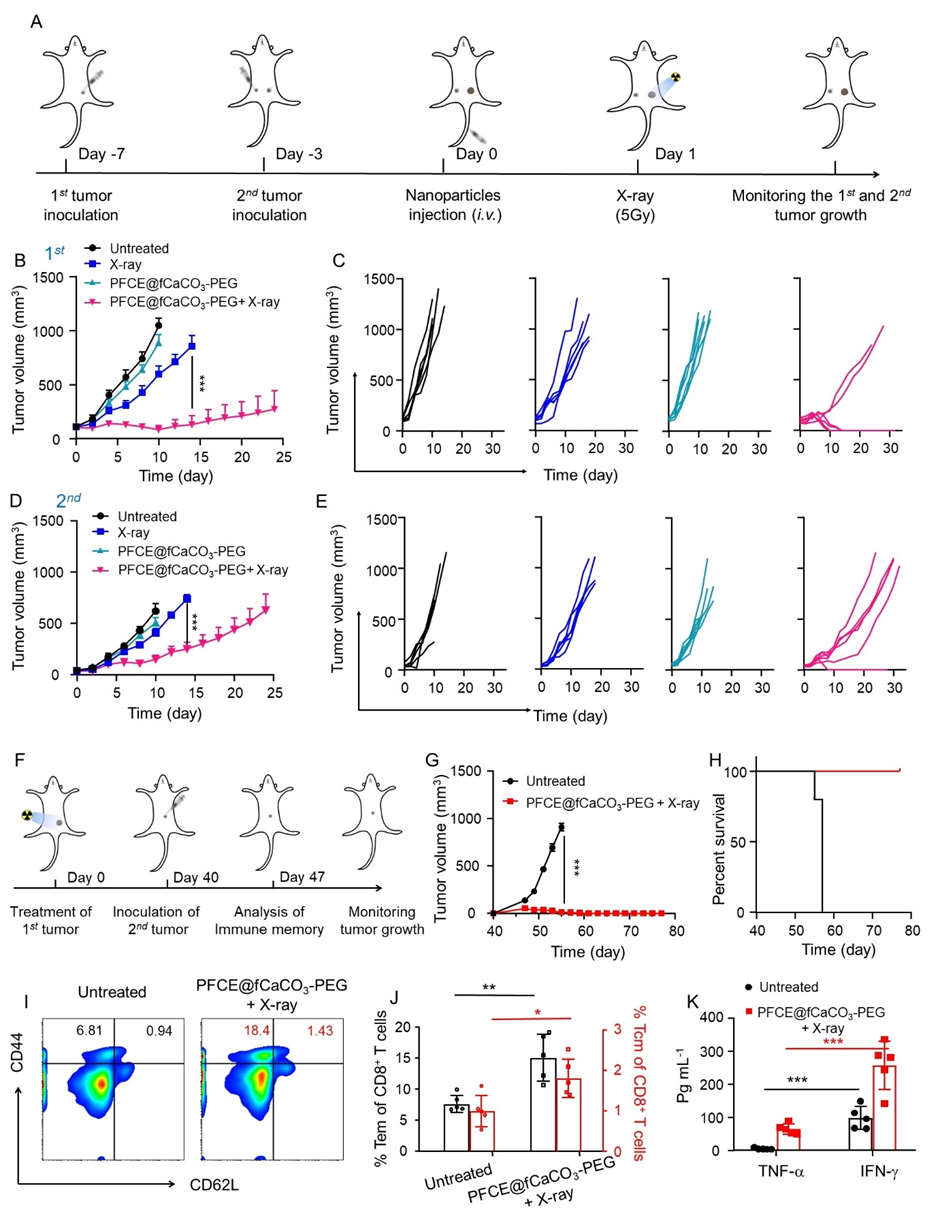
图6. PFCE@fCaCO3-PEG联合放疗的长期免疫记忆效应研究
该工作以“Chemical Modulation of Glucose Metabolism with a Fluorinated CaCO3 Nanoregulator Can Potentiate Radiotherapy by Programming Antitumor Immunity”为题发表在ACS Nano上(DOI: 10.1021/acsnano.2c02688)。文章的通讯作者为苏州大学刘庄教授和冯良珠研究员,第一作者为上海交通大学医学院分子医学研究院董自亮博士和苏州大学博士研究生王春杰。
原文链接:https://pubs.acs.org/doi/10.1021/acsnano.2c02688?fig=tgr1&ref=pdf







