伤口愈合是最复杂的动态生物学过程之一,对维持皮肤的屏障功能至关重要。虽然正常的切口型以及小面积创伤可能在一段时间内实现自动修复,但烧伤、感染、糖尿病等因素往往导致慢性的、无法愈合或反复发作的伤口,给患者和医疗系统造成了巨大困扰和损失。据统计,慢性伤口治疗的整体医疗系统成本高达每年250亿美元以上,并影响着至少650万的病人。因此,慢性伤口的治疗不仅是亟待解决的临床问题,也是关乎民生的国家重要需求,如何通过生物活性材料的设计开发实现慢性伤口的愈合调控更是极具挑战性的科学问题。
细菌感染是导致慢性伤口难以愈合的主要原因之一。目前临床上采用的清创、负压等手段辅助的抗生素治疗不仅有着花费巨大、治疗效果差、生物活性低等不足,还存在精准性不够的缺点。对此,西安交通大学郭保林课题组最近开发了具有热收缩性的智能超分子黏附水凝胶用于无创伤口闭合和MRSA感染伤口愈合。该超分子水凝胶(PNIPAm-AA/QCS-CD)由接枝β-环糊精的季铵化壳聚糖(QCS-CD)和聚N-异丙基丙烯酰胺-双键腺嘌呤共聚物(PNIPAm-AA)通过β-环糊精与N-异丙基丙烯胺的异丙基之间的主客体相互作用及腺嘌呤之间的氢键作用而交联。为了增强水凝胶的生物学性能如导电性、抗氧化性、抗菌性等,在超分子水凝胶中引入了聚吡咯纳米管(PNIPAm-AA/QCS-CD/PPY)。基于季铵化壳聚糖的固有抗菌性能,以及引入的聚吡咯纳米管,该水凝胶表现出良好的抗菌性能及光热抗菌性,能够用于体内光热抗菌治疗及促进MRSA感染的伤口愈合。在小鼠全皮层切口愈合实验中,该超分子水凝胶在表现出显著的促进伤口收缩的性能,并且其促进切口愈合的能力强于常规的手术缝合和生物胶水(图1)。此外,基于超分子化学的动态特性,该超分子水凝胶能够实现按需无痛移除。相关研究以“Supramolecular Thermo-Contracting Adhesive Hydrogel with Self-Removability Simultaneously Enhancing Noninvasive Wound Closure and MRSA-Infected Wound Healing”为题发表在《Advanced Healthcare Materials》。西安交通大学前沿科学技术研究院博士研究生于瑞和李勐为该论文的第一作者,郭保林教授为通讯作者。

图1 PNIPAm-AA/QCS-CD/PPY 水凝胶的制备示意图及性能展示

图2 PNIPAm-AA/QCS-CD/PPY水凝胶的组织黏附性能、热收缩性能、及促切口闭合和伤口收缩的测试
由于聚N-异丙基丙烯酰胺在人体生理温度下发生体积收缩,以及腺嘌呤与皮肤组织之间强的组织黏附作用,该超分子水凝胶能够以无创的方式实现对切口的闭合及促进缺损伤口收缩。研究表面,超分子水凝胶PNIPAm-AA/QCS-CD/PPY1的对猪皮的黏附强度为5.74 kPa,与商用粘合剂的黏合强度相当。该水凝胶具有特征的高温退溶胀效应。在37℃恒温箱中,水凝胶圆片在2 h内面积剩余率仅为47.2%。对于小鼠脊背中线位置的切口和缺损伤口,PNIPAm-AA/QCS-CD/PPY1水凝胶能显著促进伤口闭合和伤口收缩,24 h后,伤口剩余宽度和面积仅为23.3%和58.8% (图2)。

图3 PNIPAm-AA/QCS-CD和PNIPAm-AA/QCS-CD/PPY1水凝胶促进全皮层切口愈合
对比传统的缝合和商用胶水,PNIPAm-AA/QCS-CD和PNIPAm-AA/QCS-CD/PPY1水凝胶对于全皮层缺损伤口显示出相当的伤口闭合效率,并且由于不会对周围的皮肤产生损伤和刺激,因此具有更好的促进切口愈合的性能。对愈合14天后的伤口组织进行力学性能测试,结果显示PNIPAm-AA/QCS-CD和PNIPAm-AA/QCS-CD/PPY1组的伤口组织具有最大的抗张强度,这表明水凝胶能够更好地促进切口组织修复(图3)。

最后,作者在MRSA感染的全皮层缺损模型中,测试了PNIPAm-AA/QCS-CD和PNIPAm-AA/QCS-CD/PPY1水凝胶促进感染伤口愈合的能力,及PNIPAm-AA/QCS-CD/PPY1水凝胶辅助近红外光照抗菌促进感染伤口愈合的效果。结果显示,具有热收缩性和组织黏附性的水凝胶能够在伤口愈合初期(3,7天)显著促进伤口收缩,高效杀死MRSA,控制伤口处的炎症水平,表现为更轻的巨噬细胞浸润程度,并且能够通过上调VEGF表达,促进伤口组织进行重塑。而通过对PNIPAm-AA/QCS-CD/PPY1水凝胶辅助近红外光照,能够进一步降低CD68的表达和增加VEGF的表达,从而减低炎症水平,促进伤口组织增殖。21天后,PNIPAm-AA/QCS-CD/PPY1组的伤口显示出更高水平的胶原蛋白沉积水平,与健康的皮肤组织最为相似,因此具有最佳的促进伤口愈合的能力(图4)。
另一方面,糖尿病患者常出现下肢周围血管病变,导致足部创面供血不足。此外,足部同时承担着人体的全部重量,并且承受着大量的运动需求。外伤后,足部伤口很可能因局部移动而撕裂,敷料也更容易脱落。更重要的是,糖尿病伤口的局部高糖环境会导致细菌比正常伤口更快生长,还阻碍免疫系统杀灭入侵的细菌,增加的炎症还会导致高氧化应激,进一步引起活性氧急剧增加,从而引发连锁反应以破坏细胞。以上这些都是导致糖尿病足部创面难以愈合的主要诱因,也对糖尿病足部伤口的敷料设计提出了挑战。
对此,西安交通大学郭保林教授团队最近开发了一种针对II型糖尿病足伤口的pH/葡萄糖双响应释放糖尿病治疗药物二甲双胍的多功能水凝胶(PC/GO/Met),该水凝胶由苯硼酸/苯甲醛双官能化聚乙二醇-共聚(甘油癸二酸)(PEGS-PBA-BA)和二氢咖啡酸/L-精氨酸共接枝壳聚糖(CS-DA-LAG)间的Schiff碱和苯硼酸酯双动态共价键形成。此外,聚多巴胺包被的还原氧化石墨烯(rGO@PDA)被加入以提供导电性和止血作用。制备的PC/GO/Met水凝胶能够在大鼠II型糖尿病足模型中,通过减少炎症和促进血管生成加速伤口愈合。并且二甲双胍(Met)和氧化石墨烯(GO)的协同也被证实能进一步促进体内伤口修复。相关研究以“pH/Glucose Dual Responsive Metformin Release Hydrogel Dressings with Adhesion and Self-Healing via Dual-Dynamic Bonding for Athletic Diabetic Foot Wound Healing”为题发表在《ACS Nano》。西安交通大学前沿科学技术研究院助理教授梁永平和博士研究生李勐为该论文的第一作者,郭保林教授为通讯作者。

图5 PC/GO/Met水凝胶制备与应用示意图。
在伤口愈合炎症期的弱酸和糖尿病伤口特有的高糖环境下,Schiff碱结构解离,葡萄糖也竞争性结合苯硼酸,导致苯硼酸和邻苯二酚结合的解离,实现pH/葡萄糖双响应的水凝胶解离和Met释放。测试结果显示,在 pH 5.5和6.8 时,二甲双胍释放比在pH 7.4时分别高30.4%和12.7%。含糖环境下的二甲双胍最终累积释放量也比无葡萄糖组高 23.3%。此外,双动态键还赋予PC水凝胶良好的自愈合性以及易移除特性,确保了敷料在足部运动伤口的使用中遭遇外力破裂后可以迅速复原,并可以无痛并简易的快速实现去除和更换,这些都使得PC水凝胶在治疗II型糖尿病足创面方面具有特殊优势(图5)。

图6 PC/GO/Met 水凝胶的抗菌、组织黏附以及凝血和止血性能测试。
水凝胶中L-精氨酸的阳离子效应可以有效杀灭细菌,对E. coli和MRSA的抗菌率分别高达98.9%和99%以上,并且精氨酸的加入,还使得PC水凝胶具有的促进静脉内皮细胞增值的效果。邻苯二酚结构(来源于二氢咖啡酸)优异的组织黏附性使PC水凝胶具有良好的黏附性能,可以保证敷料与创面的完全粘合,减少外界环境对创面的潜在危害。并且组织黏附性还使得敷料具有很好的作为止血剂的优势。在凝血测试中,与对照组和市售的明胶止血海绵相比,水凝胶组保留的未凝固血液较少,并且随着水凝胶中CS-DA-LAG含量的增加,凝血指数(BCI)逐渐下降。在糖尿病大鼠肝出血模型中,水凝胶组的出血量和止血时间也都明显少于对照组和市售的明胶止血海绵组(图6)。此外,邻苯二酚还提供了水凝胶良好的抗氧化性能,能够捕获ROS,在过度炎症性创面中起到降低氧化应激的作用。因此,该水凝胶作为生物活性敷料在伤口愈合应用中具有巨大潜力。
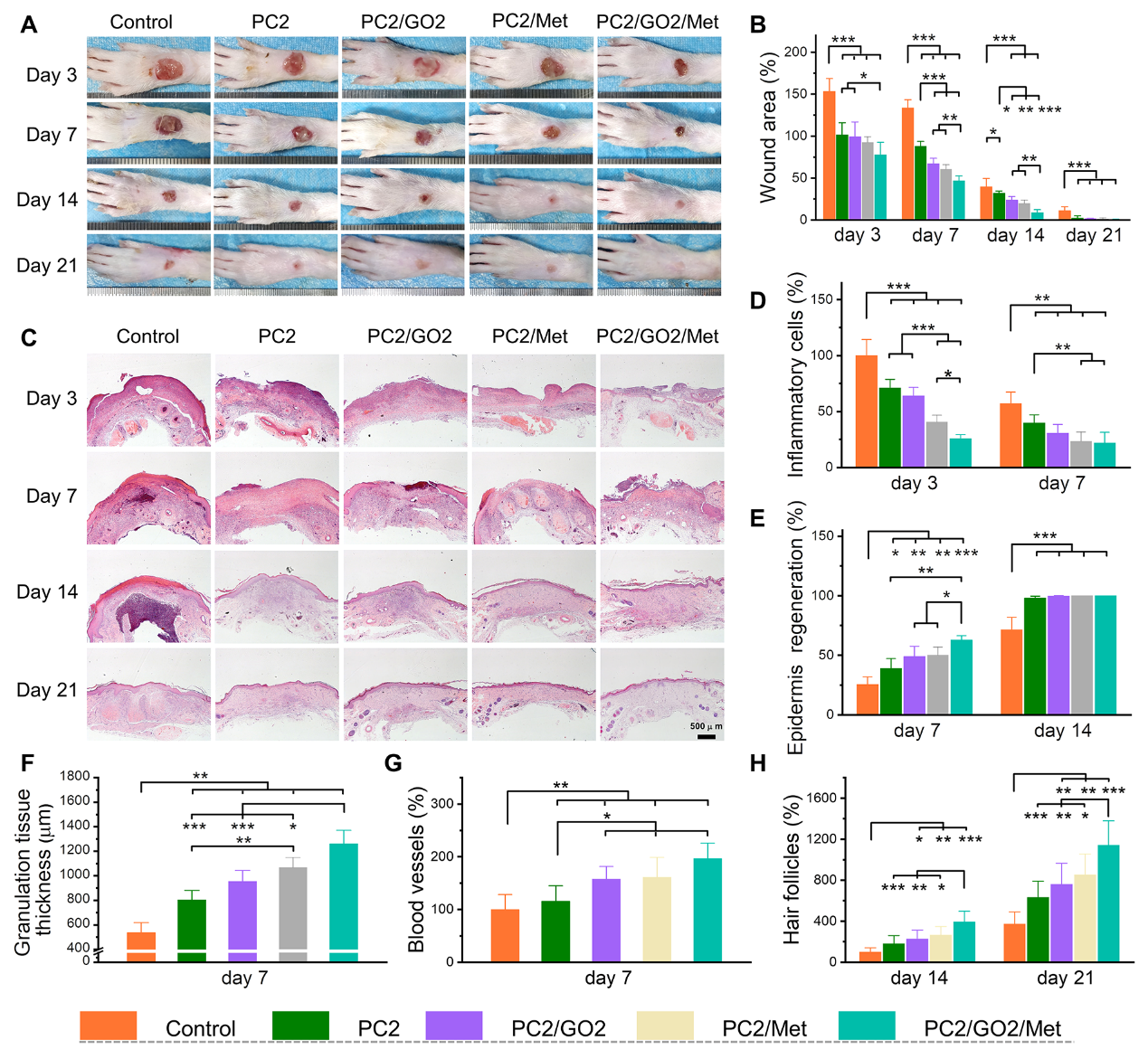
图7 II型糖尿病足模型中,不同组不同时间伤口的宏观图片和微观HE切片以及炎症、再上皮化、以及肉芽组织、血管、毛囊等的再生情况
最后,作者进一步建立了体内糖尿病足创面模型,评价了水凝胶对创面愈合的实际促进作用。实验显示,随着治疗时间的增加,创面面积明显减小,21天后,创面基本愈合。在第3天和第七7天,水凝胶组的炎症细胞明显少于对照组。在第14天,对照组表皮再生率仅为71.5%,而水凝胶组几乎完全再生。此外,与对照组相比,水凝胶治疗组肉芽组织厚度明显更厚,微血管和毛细血管大量生成,胶原沉积明显更多(图7)。免疫荧光的测试进一步证实了该水凝胶敷料通过降低炎症和增强血管再生来促进组织修复的能力。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/adhm.202102749https://pubs.acs.org/doi/10.1021/acsnano.1c11040
作者课题组简介:
郭保林,博士,教授,博士生导师,国家级青年人才计划入选者,陕西省杰出青年基金获得者,西安交通大学青年拔尖计划人才A类入选者。2011年从瑞典皇家理工学院(KTH)获得高分子材料学博士学位,师从瑞典皇家工程院院士Ann-Christine Albertsson教授。主要从事生物医用高分子材料的研究,具体研究方向包括可降解导电高分子材料、多功能水凝胶、组织工程支架与再生医学、药物控制释放体系、皮肤敷料、止血材料、可穿戴器件等。已经以第一/通讯作者在Nature Reviews Chemistry, Progress in Polymer Science, Nature Communications, Advanced Functional Materials, ACS Nano, Nano Today, Biomaterials等国际期刊发表论文100余篇,其中影响因子大于10的论文40余篇,SCI引用11000余次,H指数为57。在第一、通讯作者 SCI 论文中,多篇被Materials Today, Advanced Science News, 科技日报头版等国际知名学术新闻网站作为研究亮点评述。授权/申请发明专利10项,目前主持省部级科研项目10项,包括国家自然科学基金委项目3项。任国家自然科学基金委函评专家和中国生物学会血液净化分会委员。任 Journal of Renewable Materials副主编,Nanomaterials编委。撰写英文专著1章。
课题组主页:https://gr.xjtu.edu.cn/en/web/baoling
- 四川大学吴锦荣教授团队 Nat. Commun.:可解缠的瞬态缠结 - 实现聚丙烯酰胺水凝胶的强韧化 2026-03-07
- 四川大学孙静/范红松团队 ACS Nano:兼顾抗菌活性与细胞保护功能的类酶水凝胶用于细菌性角膜炎中的角膜再生 2026-03-05
- 新医大一附院盛伟斌教授/华科大马良教授 AFM:构建了仿生多功能水凝胶贴片-在脊髓损伤治疗方面取得新进展 2026-03-02
- 华科大牛冉/陈振兵/杨小凡 Adv. Sci.:糖工程化外泌体杂化纳米机器人增强细胞和组织渗透促进糖尿病伤口修复 2024-12-01
- Nat. Rev. Mater. 亮点报道 - 华科大罗亮/田斯丹/孟凡玲:促进糖尿病伤口修复 2024-11-28
- 东南大学葛丽芹教授/刘玲教授《Adv. Healthc. Mater.》:用于加速感染性糖尿病伤口修复的多功能自供电微针器件 2024-02-19
