软硬材料界面很容易产生应力集中,导致材料失效。然而,人体中的软硬界面组织具有优异的机械性能,该性能使用合成材料很难复制。其中,人体膝关节的“骨-软骨”界面组织(Osteochondral Interface Tissue),不仅可以实现成分、结构和机械性质完全不同的材料-软骨和硬骨之间的抗疲劳粘附,还可以在每年几百万次循环加载的过程中实现有效力传导而不发生应力集中。因此,“骨-软骨”界面组织是一个非常好的软硬材料界面模型。“骨-软骨”界面组织成功的原因在于其梯度分层的结构设计,有机-无机的复杂组装及组织力学的梯度转变。然而,目前对“骨-软骨”界面组织的超微结构、精确的生物分子组成及无机成分组装、界面微力学特性知之甚少。同时,“骨软骨”界面组织的损伤往往会引起骨关节炎,因此其再生及力学传导特性的恢复仍是巨大挑战。
在此背景下,浙江大学欧阳宏伟教授课题组对人体膝关节“骨-软骨”界面组织进行高清解析,首次从超微结构、成分组装及组织力学角度鉴定了人体膝关节里的“新”组织-“骨软骨”界面组织:并揭示了其“薄如蝉翼,化力无形”的高强力学传导及抗疲劳粘附的潜在机制。利用多种高分辨材料学表征手段,首先定义了该“新”“骨-软骨”界面组织为一个特殊的20-30 μm的超薄过渡区;该区域表现出两层微纳结构转变,羟基磷灰石(HAp)的纳米级组装异质性及大分子弹性蛋白Titin的特异性表达,成分及结构的梯度变化决定了“骨-软骨”界面组织杨氏模量的指数级跳跃(3个数量级)。成分、结构及力学的多级转变为“骨-软骨”界面组织提供了良好的力学传导及抗疲劳粘附特性(图1)。此研究于2022年3月以Identification of an ultrathin osteochondral interface tissue with specific nanostructure at human knee joint为题在线发表于期刊Nano Letters上(IF 11.189)。
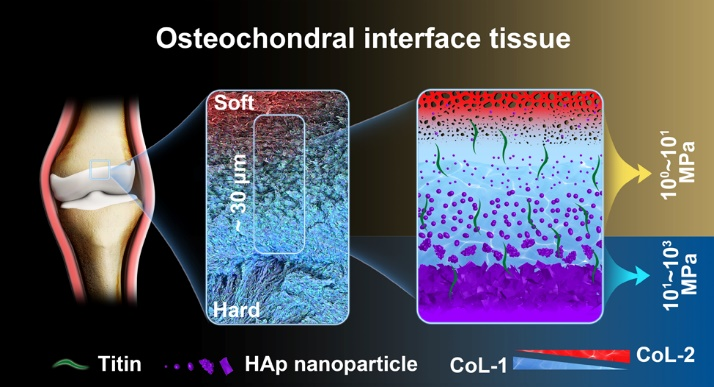
图1 “骨-软骨”界面组织示意图
首先,本研究获取了20-50岁人的正常膝关节软骨样本,利用组织学及同步辐射断层扫描技术检测了骨-软骨界面处的宏观互锁结构,初步鉴定了“骨-软骨”界面组织的存在,利用SEM-EDX线扫描确定了界面20-30 μm的超薄梯度钙化区域,并进一步利用高分辨SEM、AFM、Cryo-SEM及STEM解析了界面的超微结构转变,及HAp的复杂组装,发现了界面从多孔结构逐渐转变为致密结构,同时,HAp在整个界面的形态从球形转变为多边形,最后变为类似骨的片层结构(图2)。形态的转变,意味着HAp组装的成熟。空间梯度分布的HAp有利于降低应力集中,促进力学传导。

图2 “骨-软骨”界面组织的两层微纳结构转变
“骨-软骨”界面组织的组织模量图谱呈现两阶段的指数增加特性,并在30 μm空间范围内实现3个数量级的增加,有限元分析结果进一步证明该模量转变特性有利于力学传导(图3)。组织模量图谱和界面两层微纳结构转变息息相关。除了结构,界面成分的梯度转变也可通过重新分配应力来调控界面力学功能。因此,他们进一步从多尺度检测了界面的成分组装(图4-5)。利用XRD及Raman等技术,我们发现“骨-软骨”界面处的无机纳米晶体以碳酸根取代的HAp为主,随着界面的延伸,碳酸根取代率下降,晶体结晶性增加,HAp成分逐渐增加,钙磷比从1.2增加到1.6,这意味着HAp在界面逐渐成熟。进一步利用HRTEM、SAED及ELLS,从纳米尺度证明了HAp在界面处晶体组装的异质性。而具有纳米级异质性的HAp对裂纹不敏感,可以通过能量耗散促进界面力学传导。
此外,他们利用LC-MS/MS对界面处的精确蛋白表达图谱进行检测,发现“骨-软骨”界面组织除了高表达已知的胶原Ⅰ,胶原Ⅱ及一些蛋白聚糖和润滑小分子外,还高表达了弹性蛋白Titin,该分子的存在可以通过可逆形变吸收能量,进而传递应力,有利于维持界面弹性及良好力学传导(图6)。

图3 “骨-软骨”界面组织的模量分布特性
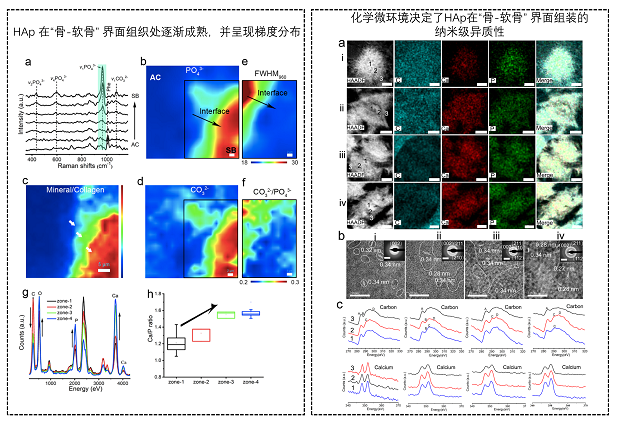
图4-5 “骨-软骨”界面组织HAp组装的纳米级异质性

图6 弹性蛋白Titin在“骨-软骨”界面组织的特异性表达
综上,他们鉴定了一个20-30 μm厚的超薄“骨-软骨”界面组织,在特征生物分子及具有纳米级异质性的HAp复杂组装的驱动下,通过结构和成分的能量吸收和耗散机制,该界面组织表现出优异的力学响应。HAp在界面处的梯度变化(结构、形态、成分及结晶性等)及界面处的多孔结构,表明HAp的矿化受到精致的细胞调控。因此,由细胞和分子调控的HAp的精致组装和纳米级梯度,有效的连接软骨和骨,有助于界面的增韧机制并有效传递载荷。因此,通过对“骨-软骨”界面组织的微结构、微力学、纳米级组装及特征生物分子表达的全面探索,揭示了天工造物的奥秘:用有限的成分,复杂精致的组装,高度有序的空间梯度及集成式的设计为组织在最短的空间范围提供最优异的力学功能。这为体外设计软-硬复合界面材料提供了最有潜力的指导。
该研究第一作者为浙江大学爱丁堡大学联合学院博士后王小召。浙江大学爱丁堡大学联合学院博士后林俊鑫为共同一作。通讯作者为欧阳宏伟教授。山西医科大学第二医院骨科段王平主任医师为共同通讯。本文得到国家自然科学基金创新研究群体(T2121004)等项目的资助。
原文链接:https://pubs.acs.org/doi/10.1021/acs.nanolett.1c04649
浙大欧阳宏伟教授课题组简介

欧阳宏伟教授课题组长期从事干细胞与骨、软骨、肌腱组织的高清解析及再生研究,突破了骨软骨组织自愈能力低下的难题,发明了“骨软骨原位修复与再生技术”,建立和实践了组织工程要素的三条临床转化途径,即自体细胞/因子浓集治疗技术、支架材料器械产品和细胞材料复合移植技术。
课题组网页:http://person.zju.edu.cn/en/ouyanghongwei;
招聘主观能动性强的博后。

王小召博士毕业于浙江大学材料科学与工程学院,2018年8月加入ZJE从事博士后研究,导师为欧阳宏伟教授。博士后研究方向为人体运动系统组织结构的高清解析及精准再生。
- 暂无相关新闻
