细胞内细菌感染与许多严重感染疾病相关,如肺结核、心内膜炎、骨髓炎、坏死性肺炎和败血症等。临床治疗难以根除胞内菌,主要原因包括:(i)抗生素的细胞膜穿透性差,胞内积累少,保留时间短;(ii)溶酶体内苛刻的酸性和水解环境降低了抗生素的抗菌活性;(iii)休眠状态的胞内菌对致命浓度的抗生素具有耐受性;(iv)细菌从溶酶体中逃脱并隐藏在细胞质内,逃避抗生素的清除作用。为了对抗这些顽固的细菌,通过精准靶向胞内菌,将抗生素递送到细菌驻留部位是一种可行的方法,但相关研究仍鲜有报道。
为此,北京化工大学生命科学与技术学院王兴教授课题组巧妙地设计了一种新型的具有级联靶向功能的药物递送系统(FAM DDS),该DDS通过级联靶向巨噬细胞和胞内耐甲氧西林金黄色葡萄球菌(MRSA),实现抗生素利福平(Rif)的原位精准递送,克服了顽固胞内菌休眠状态及隐匿位置削弱抗生素性能的瓶颈问题。与此同时,Rif@FAM能够上调巨噬细胞M1/M2极化,增强巨噬细胞免疫清除作用,协同Rif实现细胞内MRSA的高效清除(图1)。

图1:Rif@FAM级联靶向清除巨噬胞内MRSA
文章要点:
(1)Rif@FAM DDS的设计合成。课题组首次以β-N-丙烯酰基-D-氨基丙氨酸作为主要功能单体,通过光诱导聚合技术合成了特异性靶向细菌的聚合物FA,并利用动态席夫碱键接枝甘露糖获得具有靶向巨噬细胞能力的聚合物FAM,进而自组装包载Rif,构建了具有级联靶向胞内菌功能的Rif@FAM DDS(图2)。该策略为DDS提供了高密度的胞内菌靶向基团,有利于降低脱靶率;而且,氨基酸聚合物丰富的非共价相互作用力,提高了DDS的药物装载效率(18.9 wt%)和酸稳定性,实现了持续1个月的长效药物释放性能。
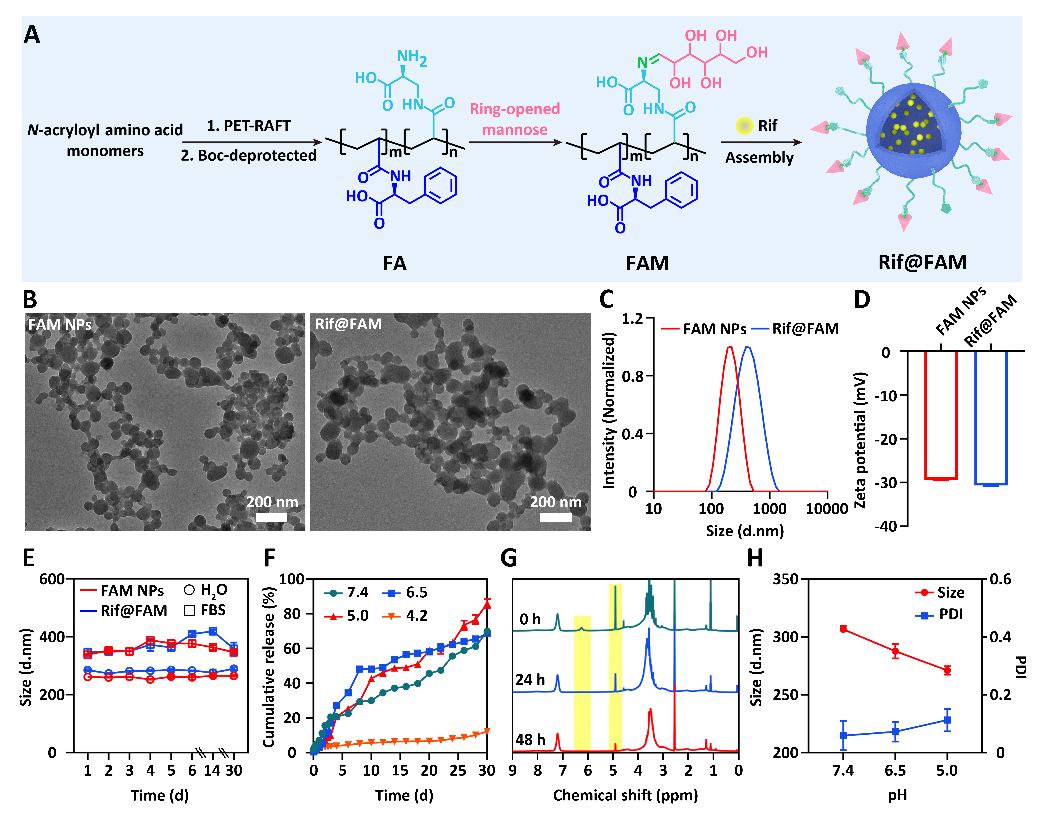
图2:Rif@FAM DDS的合成和表征
(2)级联靶向机制。研究表明,Rif@FAM首先通过甘露糖受体介导细胞内吞,选择性地进入巨噬细胞,增加了Rif在胞内的富集;随后,在溶酶体酸性环境下断开席夫碱键,触发甘露糖脱离形成Rif@FA;Rif@FA表面暴露的D-氨基丙氨酸促发粒子从溶酶体内逃逸,并特异性结合到胞内MRSA的细菌壁上,从而实现了级联靶向作用。作者通过原位/非原位共定位手段论证了FAM DDS对胞内MRSA的特异性靶向作用(图3)。三维共聚焦成像显示,FAM DDS与胞内MRSA荧光高度重合。流式细胞仪定量分析显示,细胞裂解后收集得到的胞内MRSA与FAM重合度高达71.6%,比空白组高约3倍,表明高密度D-氨基丙氨酸增强了FAM DDS和细菌的结合能力,有效避免了脱靶效应。原位TEM成像进一步证明,FAM DDS结合在胞内MRSA细胞壁上,与对照组中胞内MRSA光滑的细胞壁形成了鲜明对比。

图3:FAM DDS靶向细内菌
(3)体内抗菌活性。受试小鼠经尾静脉注射FAM DDS后,FAM DDS可在24 h内聚集在MRSA感染部位,进一步证明了FAM DDS在动物水平可实现药物的原位递送(图4)。进而,作者以单一功能的细胞靶向DDS(Rif@FM)和细菌靶向DDS(Rif@FA)为对照,研究了Rif@FAM对小鼠急性腹膜炎的治疗效果。统计数据显示,Rif@FAM实验组的胞内MRSA数量 (1.36 log10CFU) 显著低于对照组 Rif@FA (2.18 log10CFU; **, p = 0.004) 和 Rif@FM (3.24 log10CFU; ***,p = 0.0004)。结果表明,相比于单一细胞靶向和细菌靶向的DDS,FAM DDS的级联靶向与原位药物递送特性能够显著提升抗生素的治疗效果。

图4:FAM DDS的体内靶向和抗菌性能评价
综上所述,Rif@FAM通过级联靶向和原位药物递送,实现了胞内菌的高效清除。它的主要优势有:(i)实现了Rif较高的胞内积累和长时间胞内保留;(ii)强酸下结构稳定,具有长效的抗菌活性;(iii)原位精确释放Rif,克服胞内菌休眠状态及隐匿位置削弱抗生素性能的瓶颈问题;(iv)重塑了巨噬细胞的免疫反应,增强了抗菌性能。研究工作论证了级联靶向和原位递送策略对杀灭胞内菌的作用和意义,为相关疾病的治疗提供了新方法和新技术。
相关研究成果近期以“Cascade-targeting Poly(amino acid) Nanoparticles Eliminate Intracellular Bacteria via on-site Antibiotic Delivery”为标题发表在Advanced Materials杂志上 (IF = 30.849)。本论文第一作者为北京化工大学生命科学与技术学院博士研究生冯文丽。北京化工大学王兴教授、李国锋副教授为论文的共同通讯作者。该研究得到国家自然科学基金、国家创新药物重大专项、中央高校基础研究基金和北京市自然科学基金的资助与支持。
文章链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.202109789
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
- 北京化工大学王兴/李国锋团队《ACS AMI》:通过聚氨基酸纳米粒子现场递送抗生素消灭细胞内持留性金黄色葡萄球菌 2025-08-16
- 宁波大学陈重一教授 ACS Macro Lett.:基于螺旋结构聚氨基酸的强力生物粘合剂 2025-03-07
- 东华大学史向阳教授团队 AS:氧化还原响应型树状大分子纳米凝胶通过内质网应激放大和巨噬细胞极化实现超声增强的胰腺癌化学免疫治疗 2023-06-25
- 北科大郑裕东教授、上海长海医院朱世辉教授 CEJ:基于协同策略构建的具有自负压层级吸渗、抗炎和抗菌的水-气双相凝胶慢性伤口敷料 2022-09-21
- 中山大学吴玫颖/中国医学科学院生物医学工程研究所梅林 Adv. Sci.:聚吡咯纳米酶调控肿瘤相关巨噬细胞极化以增强免疫治疗 2022-06-23
