磁共振成像(MRI)技术可以将疾病诊断的准确性提升至更高水平,已成为临床上高度依赖的诊断设备之一,具有高空间分辨率、良好的软组织对比度、无创性、安全性等特点。与此同时,MRI造影剂的使用极大地扩大了MRI技术的临床应用范围。由于T1或T2加权造影剂和T1/T2双模造影剂固有的局限性,MRI造影剂的发展仍是研究热点之一。
南方医科大学沈折玉教授长期聚焦于MRI造影剂相关研究,在近期关于MRI造影剂的工作基础上(Nano Letter. 2021, 21, 9551-9559; Small 2020, 16, 1906870; Biomaterials 2020, 244, 119979; Biomaterials 2020, 235, 119783; Nat. Commun. 2019, 10, 1241; Small 2019, 15, 1903422; ACS Nano 2018, 12, 11355-11365; ACS Nano 2018, 12, 8129-8137; Adv. Mater. 2018, 30, 1803163; ACS Nano 2017, 11, 10992-11004),沈折玉教授课题组提出了一种反对比度磁共振成像(Contrary Contrast-MRI, CC-MRI)新概念,即在单模MRI(单序列)中,CC-MRI造影剂在正常组织呈阳性(T1)或阴性(T2)信号,而在病变组织呈相反信号,可以显著增强病变组织与正常组织MRI图像的对比度。为了证明CC-MRI策略的可行性,沈折玉教授带领课题组成员设计并开发了一种肿瘤微环境(TME)双重响应型CC-MRI造影剂(即SA-FeGdNP-DOX@mPEG),该造影剂对正常生理条件几乎没有反应,但对弱酸性和还原性TME表现出高度响应性,显著增强了肿瘤组织与正常组织“一正一反”的MRI对比度,有效实现了肿瘤的CC-MRI和特异性化疗。该工作以“A Tumor Microenvironment Dual Responsive Contrast Agent for Contrary Contrast-Magnetic Resonance Imaging and Specific Chemotherapy of Tumors”为题发表于Nanoscale Horizons 2022, DOI: 10.1039/D1NH00632K(影响因子10.989)。
在本研究中,功能化聚合物mPEG-FBA-CA偶联在核/壳型Fe/Gd杂化纳米粒子(FeGdNP)表面形成FeGdNP@mPEG,随后负载上阿霉素(DOX),通过自组装聚集形成SA-FeGdNP-DOX@mPEG纳米粒子。在正常生理条件下,SA-FeGdNP-DOX@mPEG具有以下特点:1)血液循环时间长,无肾排泄,由于理想的粒径(~ 100 nm),肝、脾摄取减少;2)自组装结构导致DOX释放缓慢;3)由于高r2(336.9 mM-1 s-1)和高r2/r1比值(18.4), MRI呈阴性信号(图1)。然而,在肿瘤组织弱酸性和还原性微环境(pH ~ 6.8, CGSH= 2 ~ 20 mM)中,酸不稳定的苯甲酸亚胺和GSH不稳定的二硫键都会断裂,导致mPEG脱落,从而使SA-FeGdNP-DOX@mPEG纳米粒子解聚。因此,1)解聚的纳米粒子(即FeGdNP-DOX)由于粒径小(约5 nm),有利于渗透至肿瘤深处释放药物;2)解聚后DOX释放速率加快;3)由于FeGdNP的高r1值(20.32 mM-1 s-1)和低r2/r1比值(7.2),MRI呈阳性信号。

图1. CC-MRI造影剂SA-FeGdNP-DOX@mPEG的构建及机理示意图
由于组装紧密,单一弱酸性或还原性条件很难使SA-FeGdNP-DOX2@mPEG2纳米粒解聚,而弱酸性和还原性条件(双响应)能导致mPEG的快速脱落和SA-FeGdNP-DOX2@mPEG2纳米粒的快速解体(图2)。另外,SA-FeGdNP-DOX2@mPEG2纳米粒在pH 7.4且不含GSH的条件下孵育24小时后几乎不能引起r1值和r2/r1比值的变化(r2/r1比值高,显示“负”MRI信号)。而在pH 6.8和10 mM GSH孵育下,r1值显著增强(* P < 0.05),r2/r1比值显著下降(*** P < 0.001),打开“正”MRI信号,可用于肿瘤的CC-MRI。
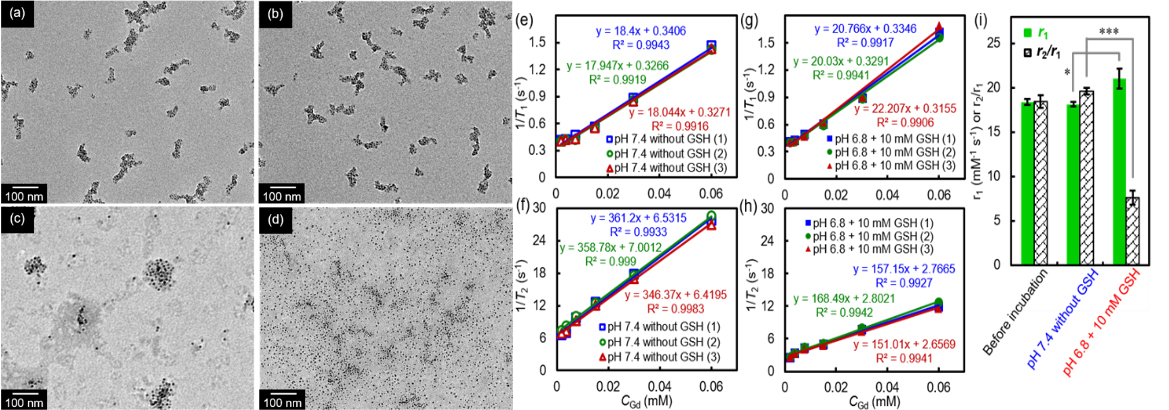
图2. CC-MRI造影剂的pH和/或GSH响应性测试及对应的体外弛豫率评价结果
为了评价CC-MRI的有效性,将SA-FeGdNP-DOX2@mPEG2静脉注射到U-87 MG荷瘤小鼠体内(Gd剂量为5.0 mg/kg),并将肿瘤信号与肝脏信号进行比较(图3)。注射后24 小时,肿瘤的MRI信号达到最大值(ΔSNR为302±32%),而肝脏的MRI信号最小(ΔSNR为-199±30%)。因此,在单模MRI序列(TE = 30 ms, TR = 1000 ms)中,TME双重响应型造影剂SA-FeGdNP-DOX2@mPEG2的智能MRI信号切换实现了CC-MRI,显著增强了肿瘤与肝脏MR图像的对比度,其ΔSNR差异高达501%。此外,对荷瘤小鼠的治疗研究表明,SA-FeGdNP-DOX2@mPEG2响应TME后释放的DOX能有效抑制肿瘤生长,实现高效的肿瘤特异性化疗,减少副作用。

图3. 实验小鼠体内的CC-MRI结果及体内治疗评价
南方医科大学硕士研究生卢玉蝶和南方医院冯捷医生为本文的共同第一作者,通讯作者为南方医科大学沈折玉教授。这项工作得到了国家自然科学基金、广东省自然科学基金、浙江省自然科学基金和广州市重点研发计划等项目的资助。
原文链接:https://pubs.rsc.org/en/content/articlelanding/2022/nh/d1nh00632k/unauth
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
- 浙江大学王立教授/俞豪杰教授团队 Mater. Horiz.:用于磁共振成像的氮氧自由基造影剂的研究进展 2025-02-09
- 东华大学史向阳/沈明武团队 Acta Biomater.:仿生含铜纳米凝胶用于磁共振成像引导的肿瘤化疗-化学动力学治疗-免疫治疗 2024-10-03
- 南方医科大学沈折玉教授、新加坡国立大学陈小元教授《Adv. Mater.》:一种用于MRI引导肿瘤铁死亡治疗的与逻辑门 2023-09-28
- 南方医科大学沈折玉教授课题组Biomaterials: 可激活STING通路的造影剂用于磁共振成像引导的肿瘤免疫-铁死亡协同治疗 2023-09-07
- 南方医科大学沈折玉教授课题组 AFM:一种基于有限空间控制聚集的用于增强MRI造影剂药物装载能力的普适策略 2022-11-23
- 西安交大周德重团队 Prog. Polym. Sci. 综述: 功能化聚合物用于胞质蛋白递送 2023-10-10
