细胞极性确立和极性生长是细胞成熟和分化过程中的自然现象。在牙髓组织、神经组织等的分化和形成过程中,干细胞通过细胞骨架的动态组装与定向作用进行有规律的极性生长,从而实现其在不同组织和器官中的功能化。微丝(肌动蛋白)细胞骨架在控制细胞极性建立和细胞极性生长过程中发挥关键作用,但目前通过超分子手段调控微丝极性进而调节细胞极性的研究尚未见报道。
基于人工调控细胞极性的设想,南开大学刘育教授团队利用功能化高分子链修饰的磁性纳米粒子与环糊精修饰的透明质酸(HACD)进行超分子组装(图1),将组装体引入到细胞体系当中,成功实现了磁场诱导下的定向细胞极性确立和极性延伸。
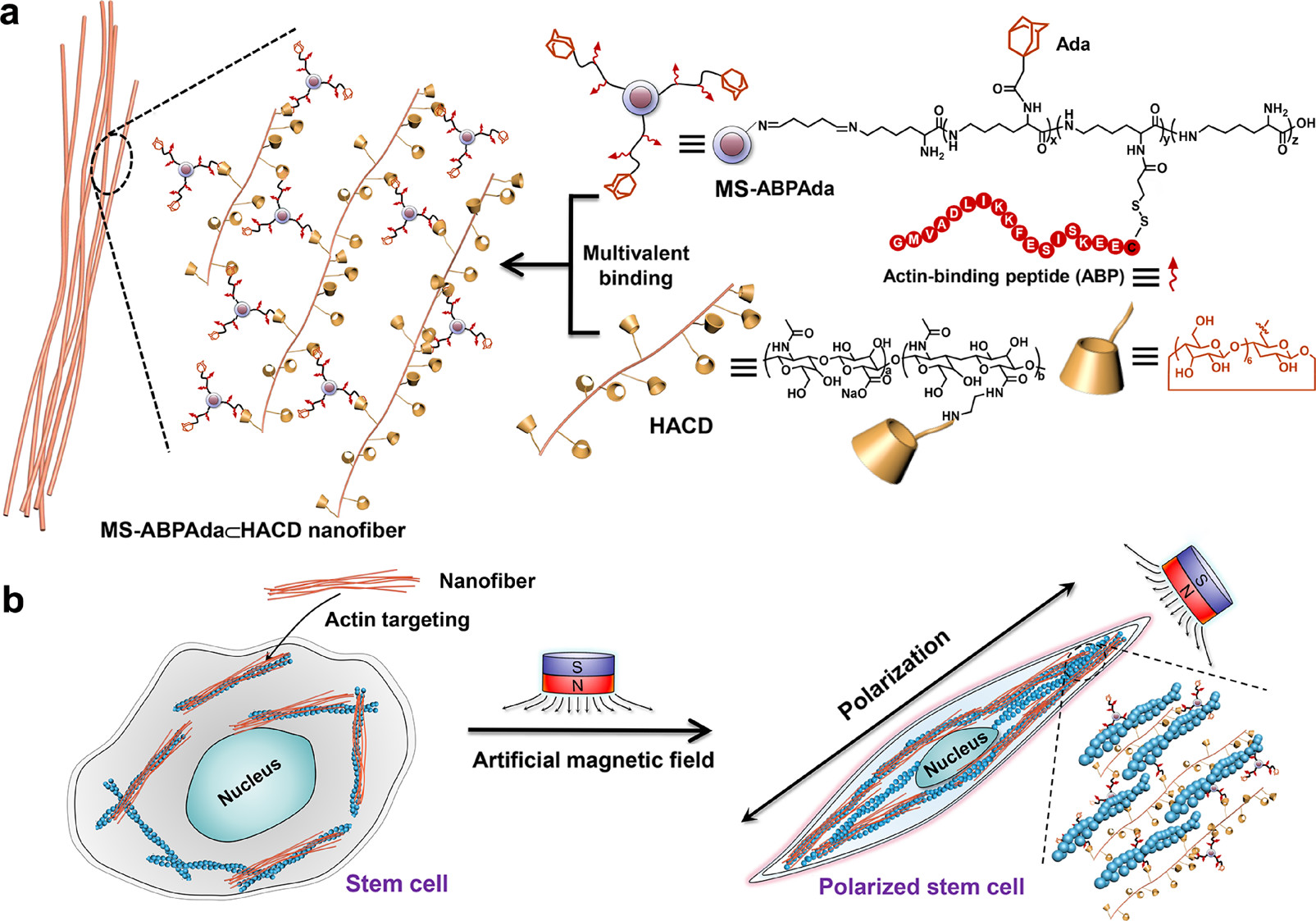
图1. MS-ABPAda?HACD 纳米组装体的构筑(a)及其介导的细胞极性调控(b)
在该工作中,作者首先对聚赖氨酸修饰的磁性纳米粒子进行功能化衍生。一方面,在聚赖氨酸链上共价修饰肌动蛋白靶向肽,使磁性纳米粒子具有肌动蛋白靶向能力;另一方面,在该链上共价修饰疏水性客体金刚烷,便于磁性纳米粒子与环糊精等主体分子进行超分子组装(图1)。当该功能化磁性纳米粒子(MS-ABPAda)与牙髓干细胞进行共同孵育时,由于肌动蛋白靶向肽的存在,磁性纳米粒子能够高效靶向细胞内的肌动蛋白。
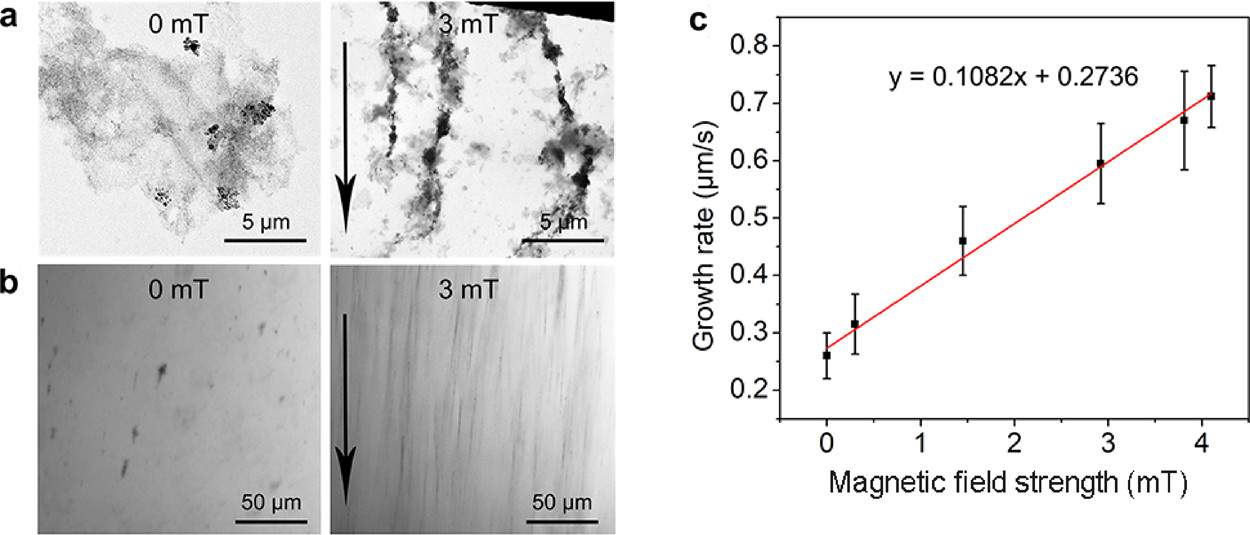
图2. 人工定向磁场诱导下形成的MS-ABPAda?HACD纳米纤维组装体。(a)纳米纤维电子显微镜图;(b)纳米纤维光学显微镜图;(c)纳米纤维组装体形成的速度与磁场强度的相关性。
在上述修饰的磁性纳米粒子基础上进一步引入环糊精修饰的多糖高分子链(环糊精修饰的透明质酸,HACD)。由于金刚烷分子与环糊精之间的强亲疏水键合作用,该组装体在体外可沿磁场方向形成超分子纳米纤维(MS-ABPAda?HACD),并且纳米纤维的生长速度与磁场强度呈正相关(图2)。在定向磁场条件下,该组装体首先发生解组装并通过内吞作用进入细胞,随后在细胞内靶向肌动蛋白细胞骨架并重新定向组装成纳米纤维。有趣的是,纳米纤维能够诱导肌动蛋白沿磁场方向发生重新定向,进而导致细胞沿磁场方向确立极性(图3)。
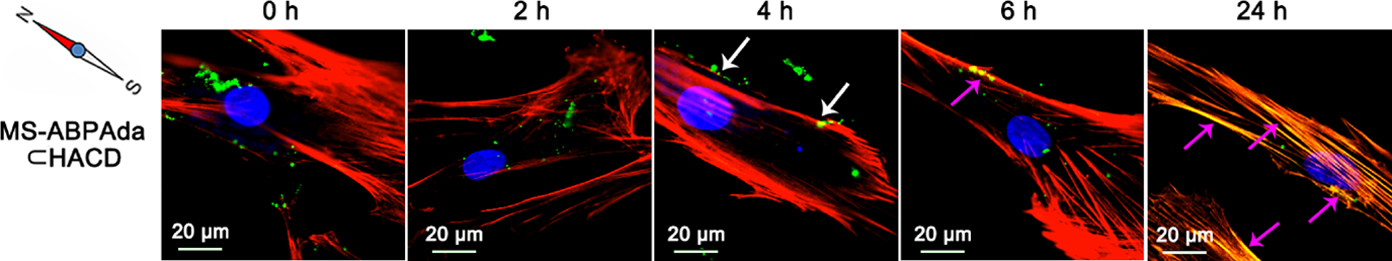
图3. 定向磁场条件下,MS-ABPAda?HACD组装体通过内吞作用进入细胞并诱导细胞的极性重构
该工作不仅首次通过功能化超分子组装体实现了对细胞极性的调控,而且为体外精准调控细胞行为提供了新的思路。
以上成果发表在ACS Applied Materials & Interfaces (2021, DOI:10.1021/acsami.0c19428)上。论文的第一作者为南开大学化学学院博士后张冰,通讯作者为刘育教授。
原文链接:
https://doi.org/10.1021/acsami.0c19428
- 苏州大学迟力峰教授/仲启刚教授 JACS:超分子组装诱导合成全同立构碗烯聚合物 2026-02-13
- 郑州大学化学学院张伟教授团队招聘教师及博士后 - 高分子合成、手性高分子、超分子组装和功能高分子材料、DFT和分子动力学计算合成/组装 2026-01-12
- 二十余载深耕|北京大学范星河教授编著新书《聚合物链超分子组装与功能化: 甲壳型液晶聚合物》出版 2025-01-14
- 四川大学高会乐教授和成果教授 Small:一种鼻腔给药的脑靶向纳米递药系统用于阿尔茨海默病的联合治疗 2022-07-06
- 浙江海洋大学欧阳小琨教授课题组《Carbohyd. Polym.》:用于快速止血和促进伤口愈合的纳晶纤维素/海藻酸钙多孔微球 2022-06-26
- 天津大学赵燕军教授团队 AFM: 用于铁死亡增敏的机械力应答聚合物 2022-04-29
- 武汉大学张先正教授团队 ACS Nano:阳离子磁性纳米粒子激活自然杀伤细胞用于治疗胶质母细胞瘤 2024-12-28
