尽管纳米载药系统有助于提高药物的溶解性和稳定性、改善药物的循环时间和靶向性、降低药物的毒副作用,纳米药物通过静脉给药时不可避免的面临多重生物屏障,如血液屏障、组织屏障和细胞屏障等,导致其在临床试验中收益甚微。内源性细胞具备天然的递送优势,如长循环能力、自然的隐身性能以及定向递送能力等,有望携同纳米载药系统共同克服各种生物屏障,提高药物的生物利用度。中科大王育才教授课题组曾提出利用中性粒细胞对细菌的特异性识别,使用细菌外膜囊泡实现对循环中性粒细胞的高效劫持。并利用微光热处理肿瘤组织触发局部炎症微环境诱导中性粒细胞的浸润,实现了细菌外膜囊泡包裹的纳米药物的高效递送,从而彻底的清除残留的肿瘤细胞,抑制了肿瘤复发[1]。
然而,纳米药物经静脉注射后,会在其表面被动的吸附上一层血浆蛋白质,形成蛋白质冠。蛋白质冠的形成会屏蔽纳米药物表面配体的靶向作用,甚至导致表面修饰被降解,进而限制了纳米药物与内源性细胞的特异性结合。在前期的研究基础上,该课题组提出通过调控载体特性实现对其表面蛋白质冠的主动精准调控,并利用蛋白质冠实现内源性中性粒细胞的劫持,进而利用中性粒细胞的天然递送优势实现纳米药物的高效递送(图1)[2]。
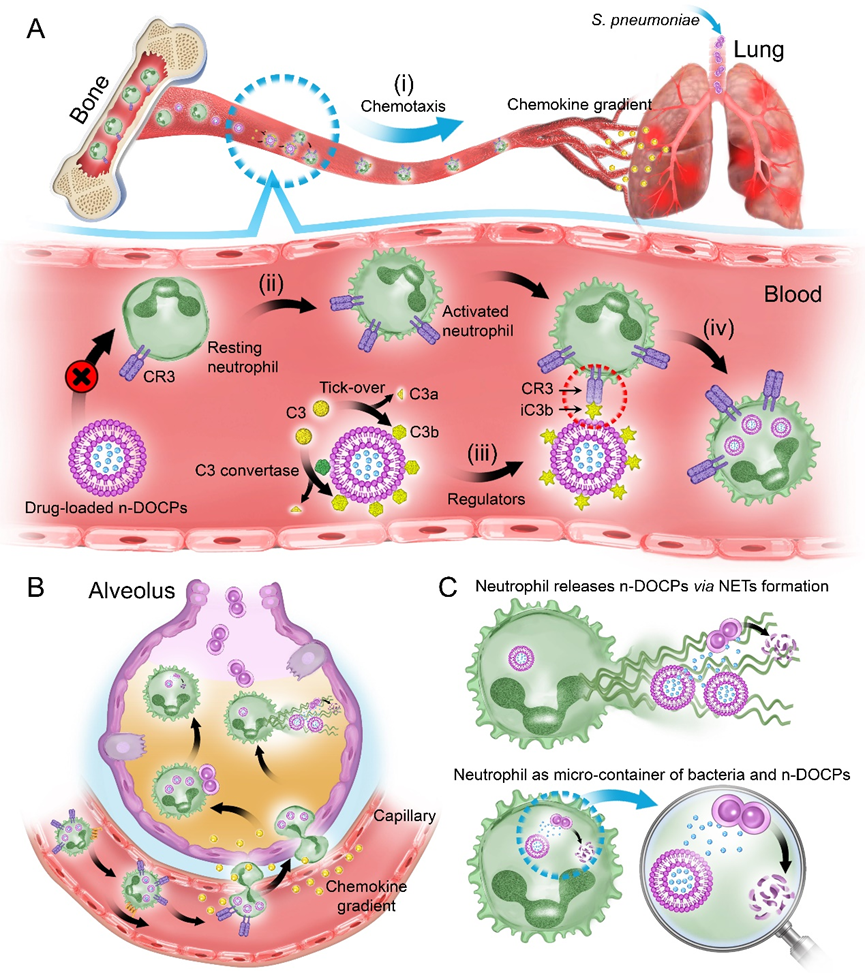
图1.反转脂质体主动诱导补体蛋白吸附用于靶向活化的中性粒细胞实现药物高效递送。
为了评估纳米载体表面特性对中性粒细胞靶向的影响,作者筛选了不同表面特性的脂质体,所含脂质的疏水尾部一致,而亲水头部的化学结构和电性不同。通过流式细胞术和活体显微成像实时观察证明头部反转的脂质体(n-DOCPs)能够特异高效地靶向血液中活化的中性粒细胞(图2)。
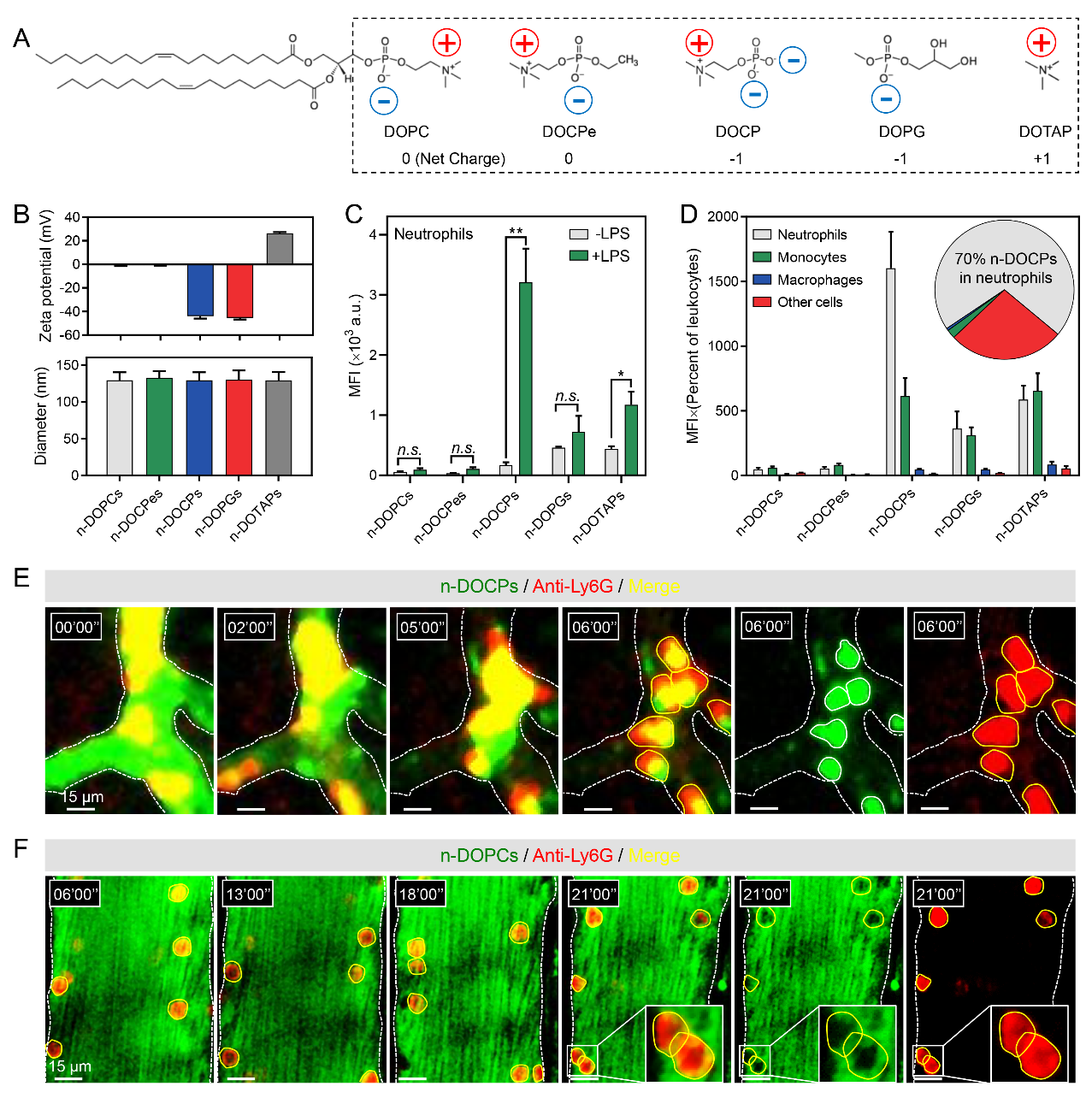
图2.反转脂质体靶向活化中性粒细胞。
作者接着探究反转脂质体高效靶向活化中性粒细胞的机制,发现中性粒细胞的活化状态和纳米载体表面蛋白质冠的组成直接影响了纳米载体与中性粒细胞的亲和力(图3)。证明了反转脂质体在血液环境中能够自发的激活补体调理作用,诱导形成富含补体片段iC3b的蛋白冠。该补体片段能够特异的与中性粒细胞表面补体受体CR3相互识别和结合,诱导中性粒细胞的吞噬作用。此外,活化的中性粒细胞会高表达CR3,从而提高了反转脂质体的靶向特异性。据此证明通过调控纳米载体表面特性能够改变蛋白质冠的组成从而实现对特定细胞的亲和力。
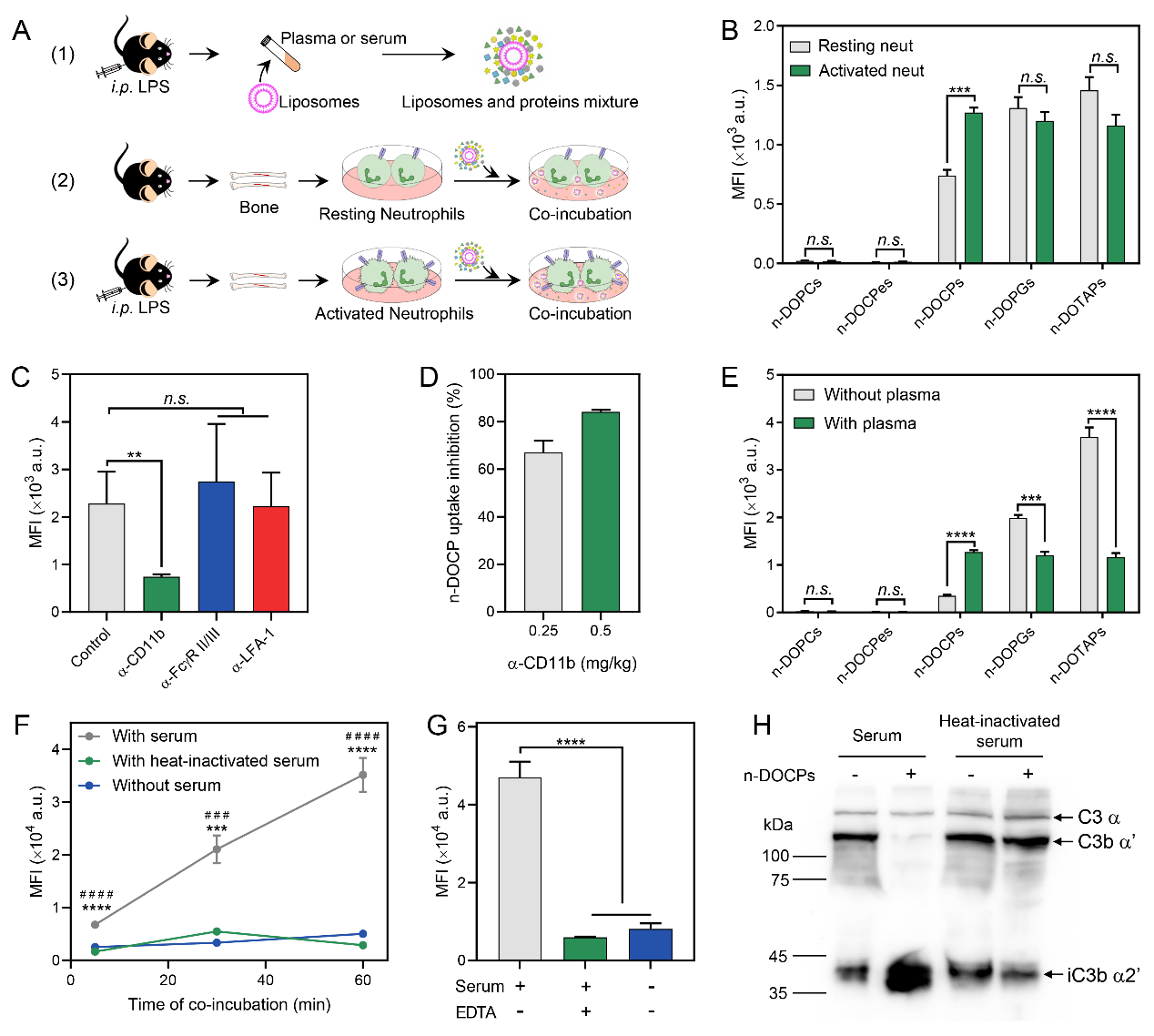
图3.蛋白质冠介导反转脂质体靶向活化中性粒细胞。
其次,作者考察了中性粒细胞携载纳米药物能否克服生理屏障实现纳米药物的病灶富集,以及胞内纳米药物如果在病灶部位发挥功效(图4)。由于肺组织存在肺泡毛细血管屏障,纳米药物只有突破该屏障才能在病灶部位富集,通过活体显微成像的实时追踪观察、流式细胞术分析、以及小动物成像仪检测证明中性粒胞能够利用其炎症趋化作用将纳米药物递送到炎性肺实质中。在病灶部位,中性粒细胞应答炎症刺激形成细胞外捕获网实现纳米药物的释放。此外,胞内菌是克服细菌耐药的难题,该体系证明携载纳米药物的中性粒细胞不仅能够释放药物,还能作为细胞反应器,将细菌吞入胞内,利用胞内高浓度的药物进行细菌的杀伤作用。

图4.中性粒细胞携载纳米药物克服肺泡毛细血管障碍并发挥功效。
作者利用反转脂质体包载糖皮质激素地塞米松进行静脉注射给药,有效的缓解了急性肺损伤小鼠的肺炎状况。在临床分离的肺炎链球菌诱导的小鼠肺炎模型中,通过注射包载氨苄青霉素的反转脂质体,有效的控制了细菌的增殖,抑制了肺炎的爆发,并延长了细菌性肺炎小鼠的生存期(图5)。利用纳米药物在给药过程中自发形成的蛋白冠实现对循环细胞的靶向作用,以增强纳米药物的递送,这一策略可能为新型药物递送系统的开发带来新的机遇。
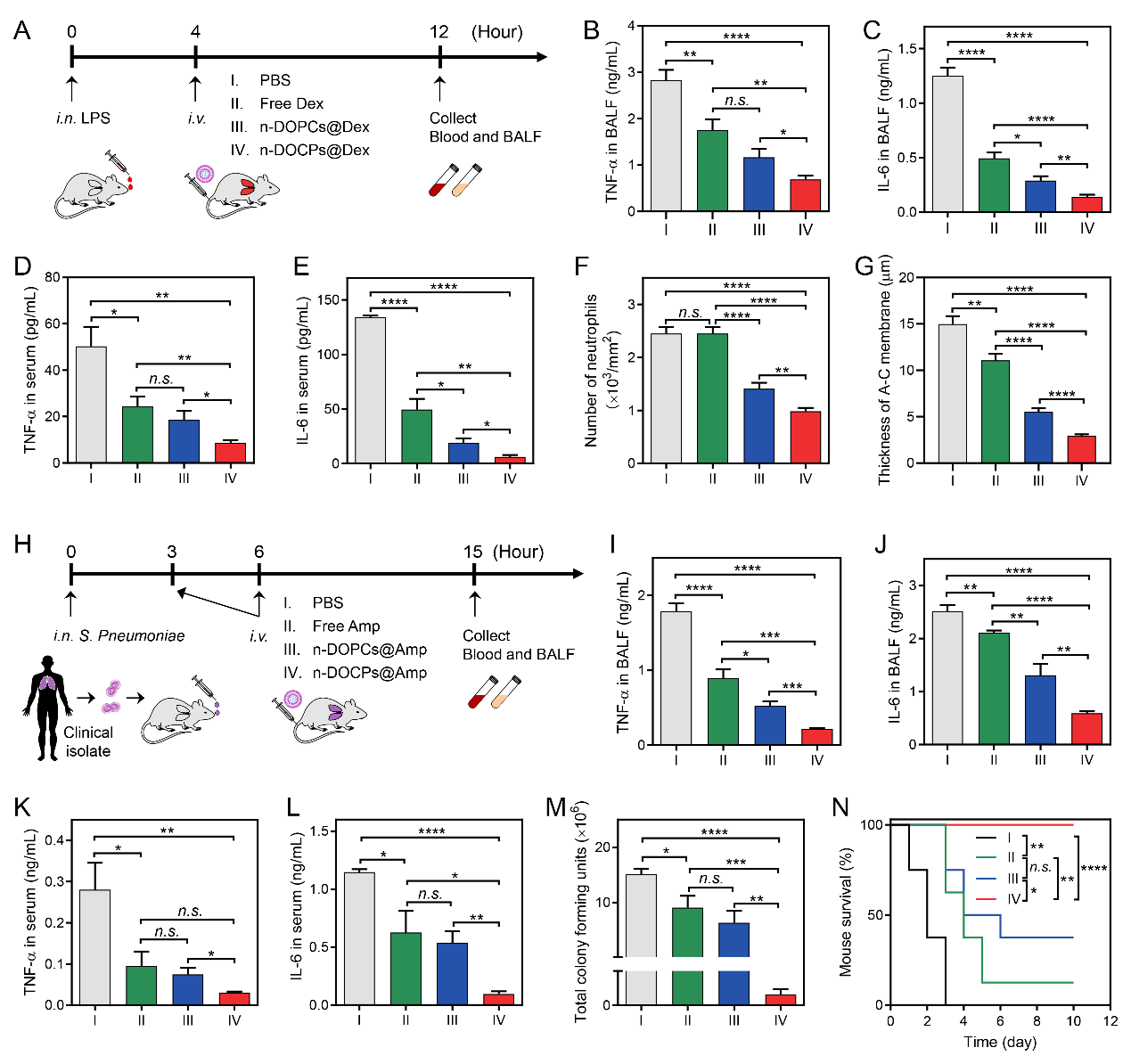
图5.中性粒细胞携载纳米药物减缓急性肺损伤和细菌性肺炎。
该研究工作近期发表于Advanced Materials。中国科学技术大学李舒雅博士和李敏博士为文章共同第一作者,中国科学技术大学王育才教授和华南理工大学王均教授为文章通讯作者。
参考文献
[1] Li, M., Li, S.Y., Zhou, H., Tang, X.F., Wu, Y., Jiang, W., Tian, Z.G., Zhou, X.C., Yang, X.Z., Wang, Y.C., Chemotaxis-driven delivery of nano-pathogenoids for complete eradication of tumors post-phototherapy. Nature Communications, 2020, 11(1), 1126.
[2] Li, S.Y., Li M., Huo, S.H., Wang, Q., Chen, J., Ding, S.G., Zeng, Z.T., Zhou, W.C., Wang, Y.C., Wang, J., Voluntary-Opsonization-enabled Precision Nanomedicines for Inflammation Treatment. Advanced Materials, 2020, Dec 9, e2006160. doi: 10.1002/adma.202006160. Epub ahead of print. PMID: 33296121.
下载:原文
- 西北大学范代娣教授、朱晨辉教授、李阳副教授 AM:基于仿生凝血级联途径的多肽修饰脂质体纳米颗粒可喷涂水凝胶治疗不可压破性创面出血 2025-04-19
- 天津大学史志远教授团队招聘科研助理 - 高分子化学、微凝胶/微囊泡/脂质体、酶包裹递送载体、微流控 2024-12-17
- 桂工甄士杰/李美静博士、广医张天富副教授、华工赵祖金教授、港中深唐本忠院士 AM:近红外二区脂质体多模态光诊疗新成果 2024-11-29
- 北京化工大学王兴教授团队《Adv.Healthc.Mater.》:基于双抗生素的pH响应型无载体纳米药物高效治疗混合细菌感染 2025-08-11
- 中科大王育才/蒋为团队 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破肿瘤血管基底膜屏障,增强纳米药物瘤内递送 2025-05-03
- 川大李旭东/陈君泽、港城大谭超良团队 Adv. Mater.: 多酚-氨基酸缩合物库用于超高载药量纳米药物的高通量连续流生产 2025-02-12
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
