目前纳米载体介导的肿瘤光治疗,特别是具有代表性的光热治疗(PTT)和光动力治疗(PDT)已取得了很大进展。光热治疗肿瘤短期效果好,光动力治疗持续时间较长。但无论是PTT或者PDT都有其不可避免的缺陷,单模式治疗难以彻底根除肿瘤。PTT和PDT协同治疗既继承了光治疗毒性低、副作用小的优点,又能使两种治疗方式取长补短,是提高疗效和减少毒副作用的有效策略。通常PTT和PDT协同治疗的抑瘤率都>95%,但肿瘤的后期复发问题没有得到有效解决。因此,构建一种能降低肿瘤复发率的新型PTT/PDT协同治疗纳米药物体系,对肿瘤后期研究和临床治疗具有重要意义。众所周知,肿瘤的后期复发绝大部分原因是前期治疗时没有彻底消除肿瘤细胞。纳米药物在肿瘤内有限的渗透深度和肿瘤内部的严重乏氧状况显著降低了PTT/PDT协同治疗疗效(PDT治疗需要氧气的支持)。

图1 [PHC]PP@HA NPs介导的PTT/PDT协同肿瘤治疗纳米体系实验设计图
近日,西安交通大学生命学院生物医学影像与应用研究所吴道澄教授课题组提出了一种新的PTT/PDT协同治疗肿瘤的策略,在降低肿瘤复发率上取得了显著进展。该研究利用具有良好生物相容性聚多巴胺(PDA)作为光热剂的同时,负载血红蛋白(Hb提供氧气)和光敏剂(Ce6)构建了小尺寸的纳米颗粒(PHC NPs)。再将具有深度肿瘤渗透能力的PHC NPs包裹进由聚乙烯亚胺(PEI)和醛基修饰的聚乙二醇(OHC-PEG-CHO)形成的胶束中,经透明质酸(HA)修饰后,形成了约140 nm的PTT/PDT协同肿瘤治疗复合纳米体系([PHC]PP@HA NPs)(图1)。PEG-PEI之间的苯甲酰-亚胺键具酸敏感特性。当复合纳米体系在HA作用下靶向到达肿瘤部位时,由于肿瘤的酸性微环境,该纳米系统由于苯甲酰亚胺键的断裂迅速解体,并释放出携带氧气并具有深度渗透能力PHC NPs到肿瘤的各个区域,从而克服了肿瘤乏氧和纳米颗粒肿瘤穿透性差的问题。

图2 肿瘤活性反馈式治疗策略示意图
在激光照射下,该纳米体系中的聚多巴胺发挥光热作用、血红蛋白为Ce6发挥光动力作用提供氧气,PTT/PDT协同杀死肿瘤。血红蛋白释放氧气的量根据肿瘤活性调节,肿瘤活性越高的区域酸性越强,血红蛋白释放氧气的量越多,PDT治疗强度也越高,反之亦然(图2)。这种根据肿瘤活性调节治疗强度的反馈式治疗策略使得在肿瘤的各个活性区域PTT/PDT协同治疗都能发挥出最大的疗效,肿瘤组织消除更干净,而对正常组织的毒副作用极低。如图3所示,体内抗肿瘤实验显示,[PHC]PP@HA NPs介导的PTT/PDT协同治疗作用具有很好的抑瘤效果,在20天内肿瘤抑制率接近100%,肿瘤生长曲线基本保持不变。此外,观察治疗过程中小鼠体重的变化。所有组均未出现明显的体重波动。在第20天,获取小鼠重要器官并用H&E染色,以研究潜在的体内毒性。所有治疗组的主要器官均未出现明显的病理异常,表明[PHC]PP@HA NPs无明显的全身毒性。小鼠的生存曲线显示,在60天内治疗组没有一只小鼠死亡,且肿瘤复发率仅为8.3%,明显低于目前很多的研究报道结果。这表明[PHC]PP@HA NPs具有的根据肿瘤活性调节PTT/PDT协同治疗强度的反馈式策略,使得PTT和PDT协同作用发挥到最大功效,取得了好的治疗肿瘤效果,显著降低了肿瘤复发率。
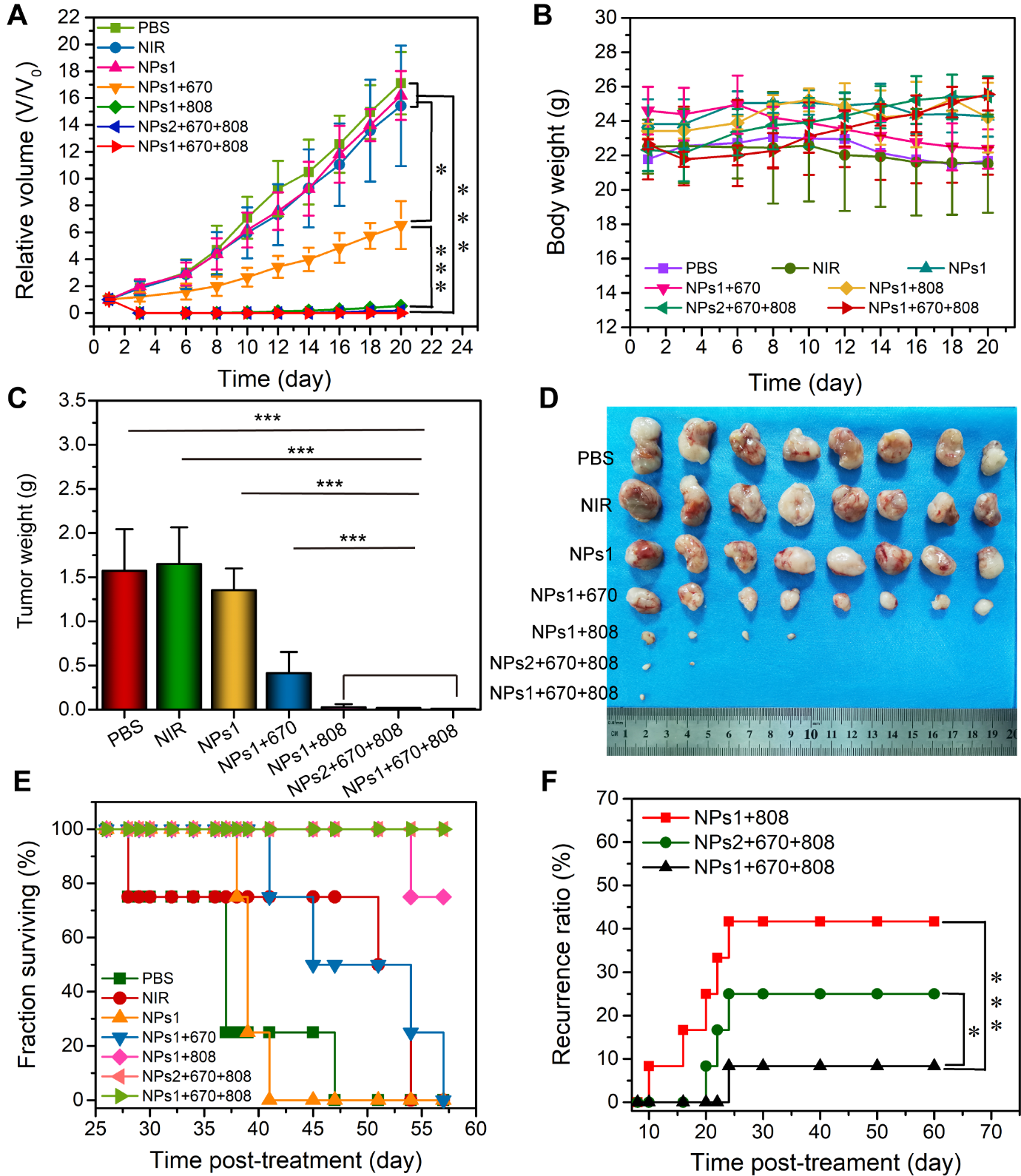
图3 (a)肿瘤生长曲线;(b)治疗后小鼠体重变化;(c)和(d)治疗20天后每组的肿瘤照片和重量;(e)60天内小鼠的生存曲线;(d)60天内小鼠肿瘤复发曲线
该研究成果日前以“Highly Penetrable and On-Demand Oxygen Release with Tumor Activity Composite Nanosystem for Photothermal/Photodynamic Synergetic Therapy”为题在国际著名学术期刊ACS Nano (IF=15.5)上在线发表,第一作者为西安交通大学生命学院博士生王雅,吴道澄教授为唯一通讯作者,西安交通大学生命学院为该论文的第一和唯一通讯作者单位。该研究成果是吴道澄教授课题组于2019年在光热疗治疗肿瘤复发后(Biomaterials 2019, 88;12-23,IF=10.4 ),在降低肿瘤复发方面又一重要成果。该成果也是博士生王雅继2019年第一作者发表聚多巴胺长循环纳米药物肿瘤治疗体系 (Advanced Functional Materials 2019, 29(1); 1805582,IF=16.4)后的又一突破性工作。
该工作得到了国家自然科学基金和国家重大科学仪器设备项目的资助。西安交通大学分析测试中心为本工作提供了大量测试表征支持。
论文链接:https://pubs.acs.org/doi/10.1021/acsnano.0c06415
- 东华大学史向阳教授/沈明武研究员团队 AFM: 双驱动纳米马达用于高效肿瘤光热治疗及治疗后炎症缓解 2025-03-17
- 香港科大唐本忠院士团队/武大王富安课题组 JACS:设计一种AIE螺环近红外发射探针用于DNAzyme敏化增强的乳腺癌光热治疗 2024-12-14
- 北航潘曹峰教授/河南大学曹瑞瑞副教授团队 AFM:用于运动能量收集和光热治疗的摩擦电功能纺织品 2024-12-07
- 香港中文大学(深圳)唐本忠院士团队 ACS Nano:基于AIEgen的可见光穿透器用于深层组织感染的光动力治疗 2024-10-21
- 吉大杨英威教授、王林教授《Nano Lett.》:新型柱芳烃基共价有机骨架材料助力精准清除牙周致病菌 →放大光动力治疗效果 2024-10-21
- 仰大勇/刘培峰/姚池合作 AM:DNA纳米复合物用于基因编辑系统和光动力治疗试剂可控共递送 2024-01-19
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
