Toll样受体 (Toll-like receptors, TLR) 是参与非特异性免疫(天然免疫)的一类重要蛋白质分子,存在于原始免疫细胞膜上,能够识别病原体和肿瘤细胞从而启动一连串的免疫反应,其中TLR 2/6及TLR 7 /8的激活能分别产生抗肿瘤的关键细胞CD8+ T细胞和NK细胞。基于Toll样受体激动剂(TLRa)的治疗,特别是TLR 2/6及TLR 7 /8联合激活疗法被证实可以招募抗肿瘤T细胞攻击无免疫反应的“冷”肿瘤细胞,是一种有前景的癌症免疫治疗方式。然而目前的TLR激活疗法生物毒性较大,阻碍了其在临床应用中的进一步发展。该疗法对机体具有生物学毒性主要是因为TLRa制剂分子量过小,极易跟随血循环弥散至各器官组织中,最终导致无目的打击普通组织细胞,造成了严重并发症。针对这一问题,不少药学研究者试图开发能够共价结合不同大小的分子药物并能实现自组装的纳米结构,从而能够同时解决TLRa分子量过小的问题及实现两种TLRa协同用药的目的。
美国中密歇根大学的杜文军教授团队与芝加哥大学的Esser-Kahn团队联合开发一种TLR超分子,通过两种TLR (TLR2/6a 与 TLR7/8a)的共价连接, 生成异二体聚 (5, Scheme 1),以此能够达到增加该异二聚体识别免疫细胞并发挥作用的机会。然后在早期的实验中发现,这种异二聚体难以组装成稳定结构,不能协同发挥作用,导致疗效不高。研究者们然后采用了一种新型两亲性多糖物聚合物 (12, Scheme 1),通过纳米自主装,能够形成多维多节的类似蚕蛹的稳定结构 (Scheme 1, TEM), 同时将TLR 2/6a处于外露状态。在电镜下可以观察到,这些纳米结构的大小大约在60 × 30纳米左右。他们就这些纳米结构命名为 MTA (multicomponent TLR agonist assembly (MTA)。
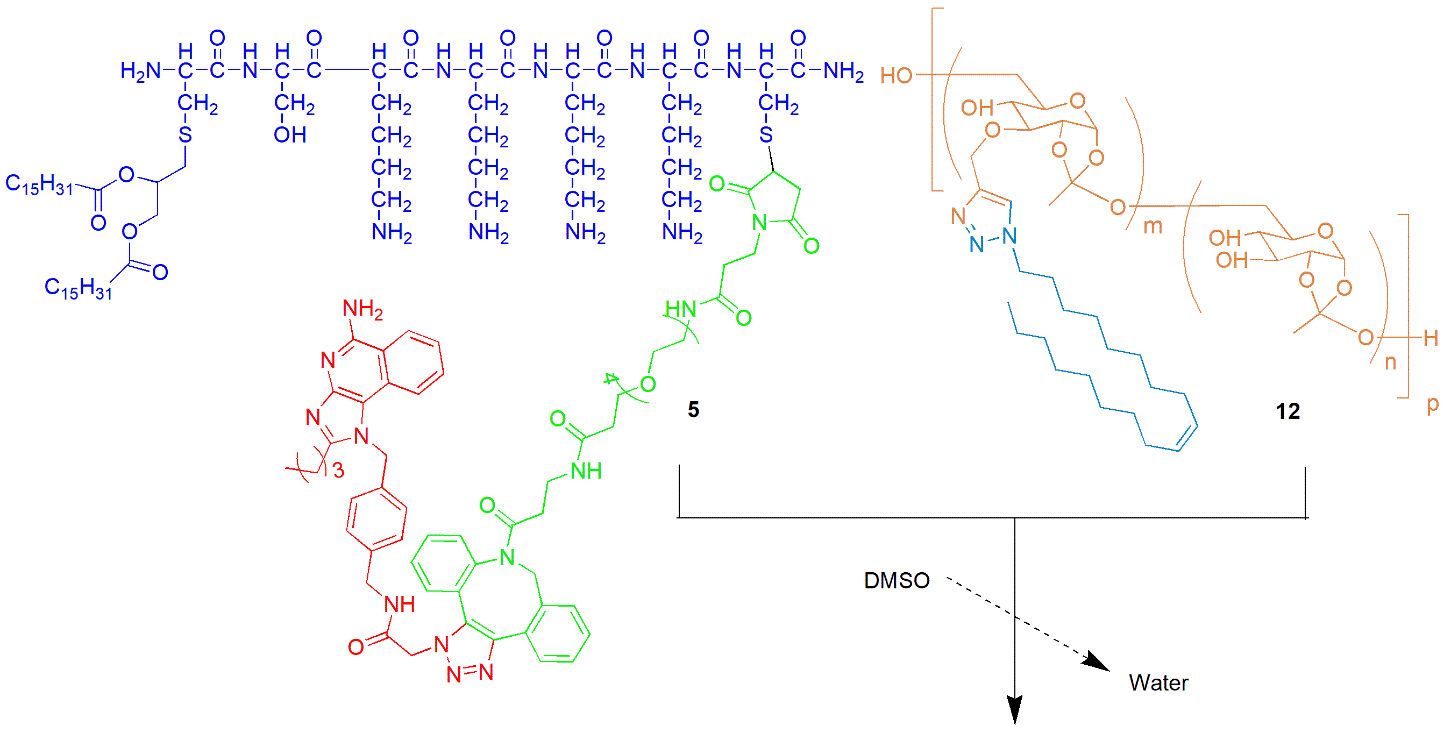

Scheme 1. co-assembly of TLR 2/6_7a (5) and amphiphilic carbohydrate polymer OL-DSPOE (12) to generate pathogen-like multicomponent TLR agonist assembly (MTA).
他们随后将这些TLR-多糖纳米自主装结构MTA, 分别在第9天以及第15天注射到负荷黑素瘤的小鼠体中 (Figure 1A),发现MTA大大提高治疗效果。与对照组相比, MTA组的小鼠存活率及存活时间大大延长(Figure 1B), 肿瘤体积也最小 (Figures 1C-1E) 。他们随后检测小鼠血清中的肿瘤浸润细胞 (tumor infiltrating leukocyte), CD8+ T细胞和NK细胞比例,这些免疫细胞是对肿瘤免疫的关键细胞。他们发现, MTA 组的这些肿瘤免疫细胞的数量显著高于对照组(PBS)、TLR2/6a LR7a组及TLR2/6a -TLR7a结合体组 (Figures 1F-1H),最多的,高达数倍。
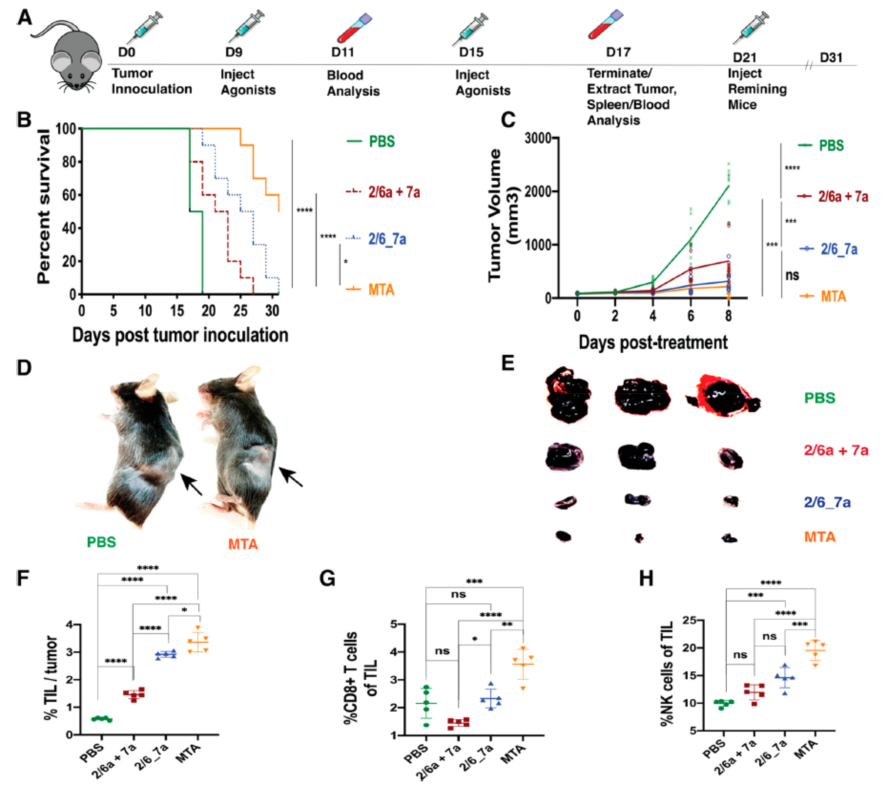
Figure 1. MTA enhances efficacy. (A) Study schedule. Mouse were injected with agonists on day 9, 15, and 21 post tumor inoculation and bled 2 days post first and second injection. Cohorts of mice were terminated on day 17 and their spleens and tumors were extracted. The study was terminated on day 31. (B) Kaplan?Meier survival analysis of mouse treated with various agonist formulations. (C) Growth curves for tumors between d0 post agonist administration (d9) to d8 post agonist administration (d17). (D) Representative images of mice treated with PBS or MTA on day 17. (E) Representative tumors extracted from mice on day 17. (F?H) Tumor-infiltrating leukocyte (TIL) analysis F. Percentage of TIL (CD45+ cells) per tumor. (G) Percentage of CD8+ T-cells of total CD45+ cells. (H) Percentage of NK cells of total CD45+ cells (Figure B, C n = 10, statistical analysis conducted in B by using logrank test with Bonferroni-correction and in C using ANOVA, Figure F?H, n = 5.
目前,基于Toll样受体激动剂(TLRa)的治疗在临床应用的最大障碍是系统毒性。杜文军教授以及他们的团队认为, 利用MTA的纳米结构,控制了Toll样受体激动剂(TLRa) 的分散,同时,因为疗效提高,用药量也大大减少, 这样可能能够降低毒性,为这种新的免疫疗法进入临床扫清最后障碍。杜文军教授以及Esser-Kahn教授带领他们的团队,对血象做了详细的检查,包括白细胞总数, 淋巴细胞总数, 单细胞数量等(Figure 2),他们发现MTA组与PBS组基本无差异, 表现出非常低的系统毒性。而相比较, 单独的或者没有纳米组装的2/6a + 7a组,毒性非常高。比如白细胞的数量降低数倍到数十倍 (Figure 2A)。同时他们也检查了对骨髓抑制及脾脏肿大反应, 都发现纳米组装的Toll样受体激动剂(TLRa) 对毒性的降低十分明显。这些结果,与MTA组的小鼠存活率及存活时间最长的结果相呼应。
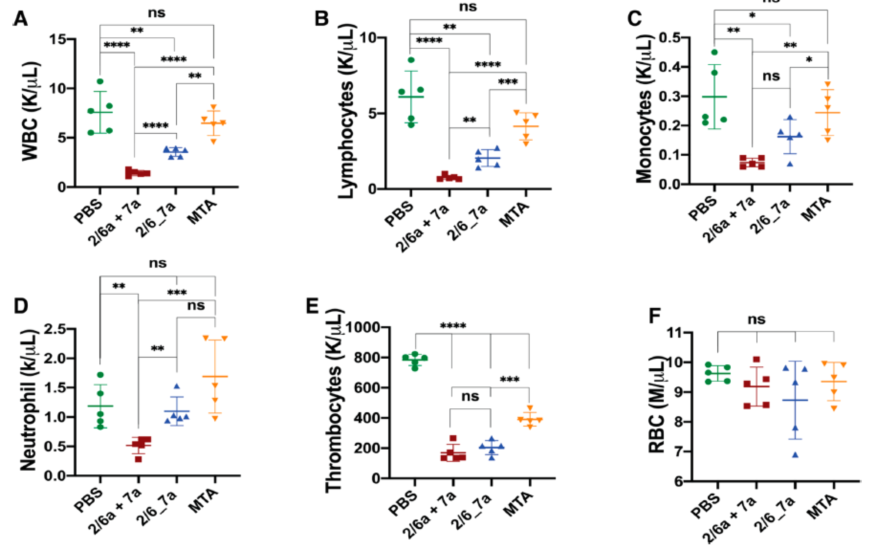
Figure 2. Hematological toxicity analysis. (A?F) Blood cell counts 2 days post first injection (n = 5, statistical analysis conducted using ANOVA with Tukey’s multiple comparisons test, *p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001). 2/6a + 7a: unlinked mixture, 2/6_7a: linked heterodimer, MTA: multicomponent TLRa assembly.
这些研充分说明了利用多糖材料纳米组装的得到的Toll样受体激动剂(TLRa) MTA对黑素瘤的治疗效果显著,而且相比单纯的TLRa治疗, 毒性大大降低。是一种非常具有潜力的新型免疫肿瘤疗法。 该工作发表在最新一期的美国化学学会核心科学(ACS Central Science, 影响因子 = 12.695) 。 Saikat Manna 博士和Sampa Maiti 博士为主要工作完成人,中密歇根大学化学以及生物化学系的杜文军教授以及芝加哥大学的Esser-Kahn教授为共同通讯作者。
原文链接:https://doi.org/10.1021/acscentsci.0c01001
- 浙江大学周民团队《Cell》子刊:“药食同源”微藻-黄芪多糖系统减少免疫治疗不良事件并增强疗效 2025-08-26
- 广西大学林宝凤教授团队 Carbohyd. Polym.: 基于天然多糖的绿色低温缓冲包装材料的研究 2025-07-23
- 兰州理工大学牛小慧/王坤杰团队 ACS Nano: 内含界面电场的手性多糖水凝胶材料 2025-07-14
- 国科大屈小中教授课题组 Angew:在高分子-蛋白多层次结构纳米组装体制备和应用研究中取得进展 2024-02-27
- 巴黎高科化学学院李敏慧教授课题组:红光响应的含钌-多吡啶基配位化合物的聚类肽纳米组装体 2023-12-17
- 四川大学张新星教授、西工大杨勇教授 AFM:具有动态物理网络的强韧化自修复弹性体 2022-10-21
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
