根据世界卫生组织统计,癌症已经是世界第二大致死因素。化疗作为治疗癌症的主要手段,但由于缺乏肿瘤选择性,存在较大的毒副作用等问题。前药和药物递送系统是提升抗癌药物的选择性和降低毒副作用的两个有效策略。前药是活性药物的非活性前体,在人体内进行酶代谢从而活化,改善母体药物的药代动力学特征。药物递送系统可以将化疗药物靶向递送到肿瘤部位,提高治疗效果和控制药物释放。分子印迹聚合物(MIP)已经被广泛应用于药物递送,但MIP和前药的联合使用,此前未见文献报道。
近日,南京大学化学化工学院刘震教授课题组报道了一种基于分子印迹技术的纳米智能前药递送策略,论文发表于Angew. Chem. Int. Ed.(2020, DOI:10.1002/anie.202012956)。该策略以分子印迹纳米颗粒为载体,具有特异性靶向肿瘤细胞,长时间肿瘤部位保留,以及肿瘤微环境触发释放药物的特点。不同于传统的前药需要依赖肝脏的生物转化,该分子印迹前药递送体系是肿瘤依赖性的,而非肝脏依赖性的,避免了肝脏部位酶的影响。该工作为发展智能前药递送纳米载体开辟了新的路径。
对于MIP的合成,作者利用课题组自主研发的先进印迹技术—硼亲和定向可控表面印迹法(Angew. Chem. Int. Ed., 2015, 54, 10211-10215;Nat. Protocol., 2017, 12, 964–987),将目标前药5-脱氧-5-氟胞苷(DFCR)(卡培他滨的一级代谢产物)和癌症靶标唾液酸(SA)共印迹到纳米粒子上,形成双模板分子印迹聚合物(dt-MIP);当携带了DFCR的dt-MIP到达肿瘤部位时,该纳米载体能通过与SA结合而靶向识别癌细胞,同时长时间保留在肿瘤部位;在该条件下,DFCR缓慢从该载体中释放出来,被癌细胞摄取,经过两部酶转化(胞苷脱氨酶,胸苷磷酸化酶),生成活性分子5-氟尿嘧啶(FU),诱导癌细胞死亡(原理见图1)。

图1. 双模板分子印迹聚合物载药递送原理图
作者通过共聚焦荧光和流式细胞术,证明了dt-MIP对于癌细胞的靶向能力(图2)。紧接着,作者证实了载药dt-MIP可以被pH = 6.8的酸性微环境触发,可控释放药物(pH = 7.4时不释放)。同时,载药dt-MIP与HepG-2共孵育48h后,细胞抑制率为58%,证实了载药dt-MIP的细胞毒性(图3)。同时,作者考察了不同材料在荷瘤裸鼠体内的分布,相比于非靶向的纳米粒子,dt-MIP可以在肿瘤部位保留更长的时间(10天)(图4)。最后,作者考察了载药dt-MIP的抑瘤效果,相比起空白对照组(PBS)和裸药对照组(DFCR),载药dt-MIP具有最佳的肿瘤抑制效果(图5)。

图2. dt-MIP对于过表达SA的癌细胞系和不表达SA的正常细胞系特异性靶向实验结果
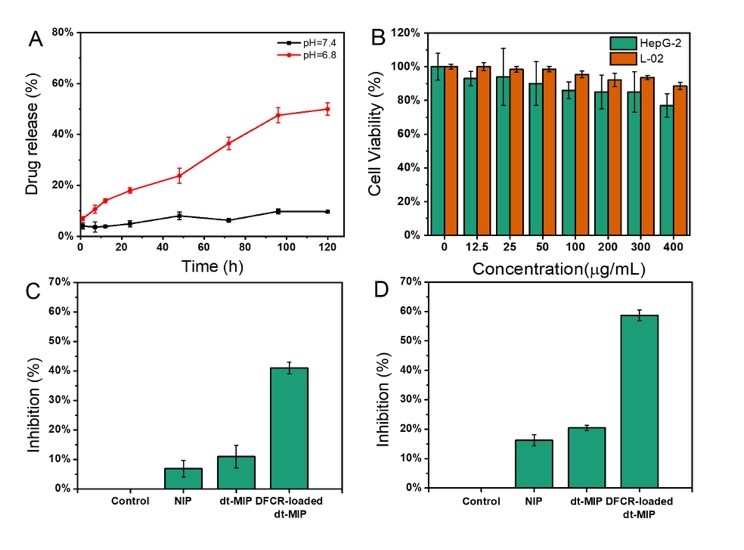
图3. A) 不同pH 条件下的药物释放曲线;B) 细胞抑制率实验结果
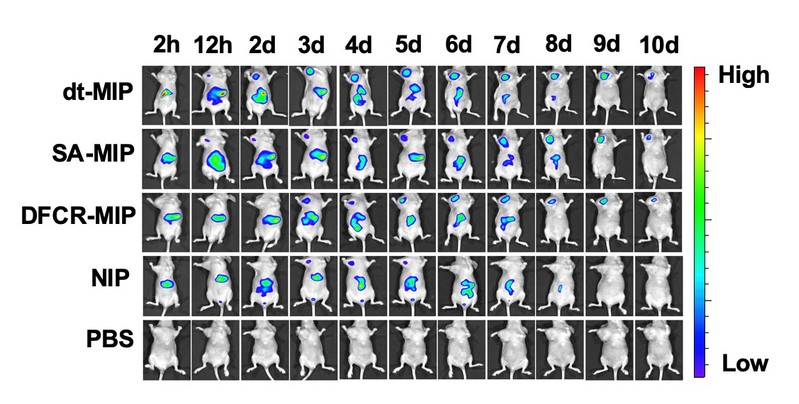
图4. 注射不同材料的荷瘤裸鼠的体内荧光分布
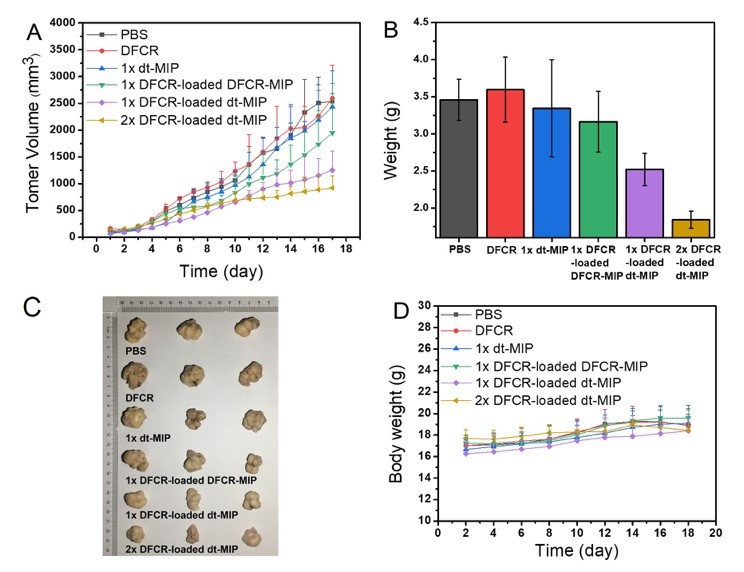
图5. 荷瘤裸鼠抑瘤实验结果
该论文的通讯作者为刘震教授,博士研究生顾自宽和已毕业硕士生董月茹为共同作者,许舒欣博士和加拿大渥太华大学医学院Lisheng Wang教授为共同作者。该工作得到国家自然科学基金重点项目(21834003)、国家重点研发计划(2018YFC0910301)和南京大学卓越计划(ZYJH004)等的经费支持。
刘震教授课题组在分子印迹技术用于抗肿瘤方面已连续取得重要进展(Chem. Comm. 2017, 53, 6716-6719; Angew. Chem. Int. Ed. 2019, 58, 10621-10625)。最近,课题组综述了近年来MIP在抗肿瘤方面的最新进展(Angew. Chem. Int. Ed. 2020,DOI: 10.1002/anie.202005309)。
全文链接:https://onlinelibrary.wiley.com/doi/10.1002/ange.202012956
- 新疆大学吐尔逊·阿不都热依木教授团队 J. Hazard. Mater./CEJ:壳聚糖基分子印迹电化学传感器的构筑及其性能研究 2025-08-06
- 新疆大学吐尔逊·阿不都热依木教授团队:在分子印迹电化学传感器领域取得一系列进展 2025-08-04
- 苏州大学张伟教授团队 Small:分子印迹策略实现圆偏振发光增强的可循环聚合物手性薄膜 2024-11-21
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
- 东南大学葛丽芹教授与合作者 Research:微气泡为模板的免疫活性金属多酚胶囊用于药物递送和增强的肿瘤免疫治疗 2025-07-31
- 四川大学丁明明教授团队 Angew: 可视化β折叠到β转角构象转变的荧光聚合物囊泡及其用于颜色报告型药物递送 2025-07-11
