中山大学陈永明/刘志佳团队及其合作者基于Ugi多组分化学开发了一类具良好生物相容性的氧化还原响应性阳离子类肽聚合物材料库,筛选的聚合物载体与蛋白药物共组装可以形成尺寸小、药物封装效率高的纳米复合物,依靠巨胞饮和/或小窝蛋白介导内吞途径进入细胞,经溶酶体逃逸后,由于胞内谷胱甘肽触发聚合物主链二硫键的快速降解,可有效地将蛋白药物释放至胞内并且保证生物活性功能,证实了多组分反应(MCR)作为一种材料发现工具可用于筛选生物功能聚合物载体材料。
蛋白药物,诸如细胞因子、酶和单克隆抗体等,具有高特异性和功效、低毒副作用,已成为一种治疗癌症或代谢疾病等适应症的重要治疗方案。据统计,2019年全球药物销量前十名中蛋白类药物占70%。然而,蛋白质的高分子量和亲水特征导致其极难渗透胞膜屏障,因此当前开发的蛋白药物主要基于细胞外靶点发挥生物功能。研究表明,相比于小分子药物,蛋白质在调节当前难或不可成药性的胞内靶点方面具有巨大潜力,因此迫切需要开发安全和高效的递送系统,改善蛋白药物胞内输送,从而促进胞内靶点型蛋白药物发展。
针对胞内递送面临的诸多挑战,目前已发展了不同策略或技术实现药物输送,例如物理或化学增强膜通透技术,蛋白质化学修饰,利用聚合物、脂质体等作为递送载体。其中,阳离子类聚合物载体由于在结构控制、稳定和保护蛋白质、改善细胞内吞和提升溶酶体逃逸效应等方面的优势而受到广泛关注。尽管取得了一些鼓舞人心的结果,当前仍需发展更加安全和有效的聚合物递送系统,实现药物高效转导和胞内可控释放,从而满足生物技术和药物治疗领域的应用需求。
最近,中山大学陈永明/刘志佳团队及其合作者提出利用条件温和的Ugi反应,通过组合合成技术获得聚合物主链含二硫键的功能阳离子类肽聚合物库(图1)。筛选的类肽聚合物载体可与蛋白模型药物(BSA, 牛血清白蛋白)共组装形成尺寸小、药物封装效率高的纳米复合物,通过巨胞饮或小窝蛋白介导内吞机制可以递送蛋白质至不同类型细胞系,经溶酶体逃逸后,依靠胞内谷胱甘肽触发聚合物主链二硫键的快速降解,可有效地将蛋白药物释放至胞浆内。实验表明筛选的阳离子类肽聚合物载体可以实现不同分子量和负电性蛋白质的高效递送,并且证明递送至胞内的超氧化物歧化酶具有高效清除活性氧自由基的生物功能。因此,证实了多组分反应(MCR)作为一种材料发现工具可用于开发具生物功能的阳离子聚合物载体,并有效地将生物活性蛋白递送至胞内实现治疗功能。
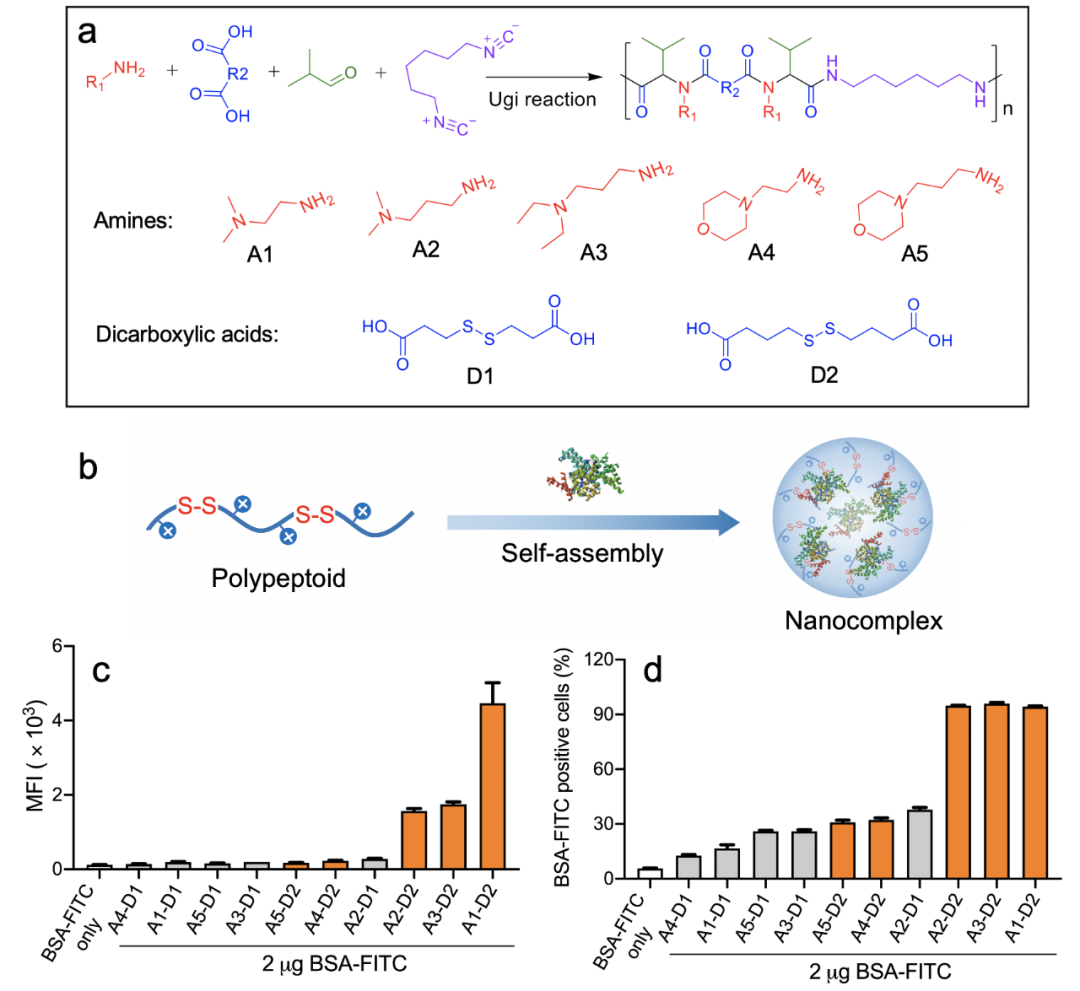
图1 基于Ugi多组分反应合成阳离子类肽聚合物载体材料及其用于胞内蛋白药物递送研究
该项工作近期在线发表于SCIENCE CHINA Chemistry。论文通讯作者为中山大学材料科学与工程学院陈永明教授和刘志佳副教授,第一作者为博士研究生乐志成。详见:Zhicheng Le, Tong Xiao, Zhijia Liu, Xingliang Liu, Hong Liu, Lixin Liu, Yongming Chen. Combinatorial synthesis of redox-responsive cationic polypeptoids for intracellular protein delivery application. Sci. China Chem., 2020.
原文链接:https://doi.org/10.1007/s11426-020-9802-0
- 西工大李鹏教授课题组 Sci. Adv.:可选择性杀灭ESKAPE耐药菌的含氟两亲性阳离子聚合物 2024-09-01
- 港中深唐本忠院士/北师大何本钊 Angew:吡啶鎓-炔点击聚合 2024-05-04
- 中科院深圳先进院阮长顺团队 AFM:小分子阳离子聚合物增强海藻酸盐生物墨水的打印性和生物活性 2023-12-14
