纳米药物是可以解决药物水溶性差和副作用大等问题而备受关注。它们通常是通过肿瘤高渗透和滞留效应富集在肿瘤部位,而肿瘤微环境成为纳米药物进入肿瘤内部以及长时间停留在肿瘤部位的障碍。小尺寸的纳米颗粒有利于向肿瘤内部渗透,却容易在血液循环中被肾清除,并且也难以在肿瘤部位停留较长时间。因此,单一地通过调控粒径实现良好的治疗效果并不现实。
近日,西南交通大学周绍兵教授团队制备了一种粒径可变的、胶原酶改性的聚合物胶束,可以同时提高其向肿瘤内部的渗透和在肿瘤部位的滞留时间,从而提高治疗效果(图1)。他们首先通过两种嵌段共聚物:端基为MAL的聚乙二醇-b-聚β氨基脂和与琥珀酸酐修饰的顺铂复合的聚己内酯-b-聚环氧乙烷-三苯基膦的共组装得到胶束,通过点击化学将胶原酶(可消化纤维蛋白)修饰在胶束表面,最后通过静电相互作用将硫酸软骨素修饰在胶束外层,屏蔽胶束正电荷的同时防止胶原酶在血液循环过程中被降解。在正常生理环境中,胶束粒径为100 nm左右,可实现体内长效循环而不被肾清除。当循环至肿瘤部位后,弱酸环境使得叔胺质子化,PBAE嵌段由疏水变为亲水,造成部分胶原酶改性的MAL-PEG-PBAE从胶束中解离,促进了对ECM中胶原纤维的降解,提高胶束向瘤内的渗透。同时,由于亲水性增加,胶束粒径也增大至250 nm,被“困”在肿瘤组织,难以回到血液循环中,增加了胶束在肿瘤的滞留时间。动物实验结果证实该纳米药物可显著提高对肿瘤的治疗效果。
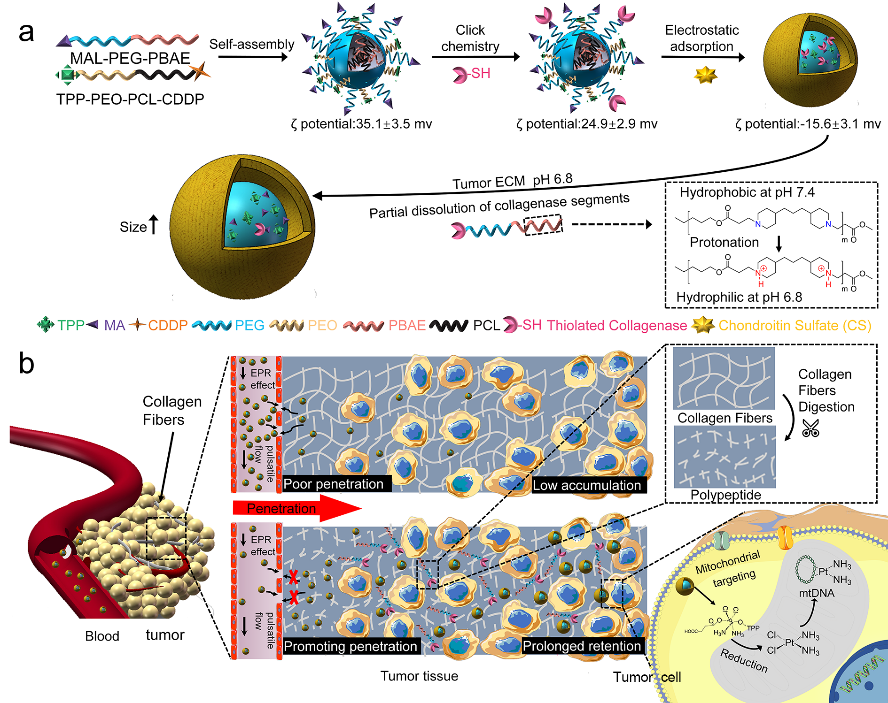
图1 尺寸可变聚合物胶束的制备及其在肿瘤组织的穿透和滞留示意图
以上相关成果发表于Advanced Materials (2020, 1906745)上。论文的第一作者为西南交通大学博士研究生徐傅能,通讯作者为王毅博士和周绍兵教授。
论文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/adma.201906745
- 北京化工大学王兴教授团队《Adv.Healthc.Mater.》:基于双抗生素的pH响应型无载体纳米药物高效治疗混合细菌感染 2025-08-11
- 中科大王育才/蒋为团队 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破肿瘤血管基底膜屏障,增强纳米药物瘤内递送 2025-05-03
- 川大李旭东/陈君泽、港城大谭超良团队 Adv. Mater.: 多酚-氨基酸缩合物库用于超高载药量纳米药物的高通量连续流生产 2025-02-12
- 中国海大何治宇/于良民 Adv. Sci.:基于传统中药冰片的聚合物胶束脑内药物递送系统-用于精确适应病理机制的缺血性脑卒中治疗 2025-01-21
- 复旦大学占昌友教授团队《Nano Today》:亲和诱捕法实现生物介质中PEG化聚合物胶束的高效分离-破译聚合物胶束的体内命运 2024-04-25
- 国科大屈小中教授课题组 Angew:在高分子-蛋白多层次结构纳米组装体制备和应用研究中取得进展 2024-02-27
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
