8月23日,《自然-通讯》(Nature Communications)在线发表华中科技大学生命学院、国家纳米药物工程技术研究中心杨祥良教授、甘璐教授课题组完成的研究论文“Tumor exosome-based nanoparticles are efficient drug carriers for chemotherapy”。
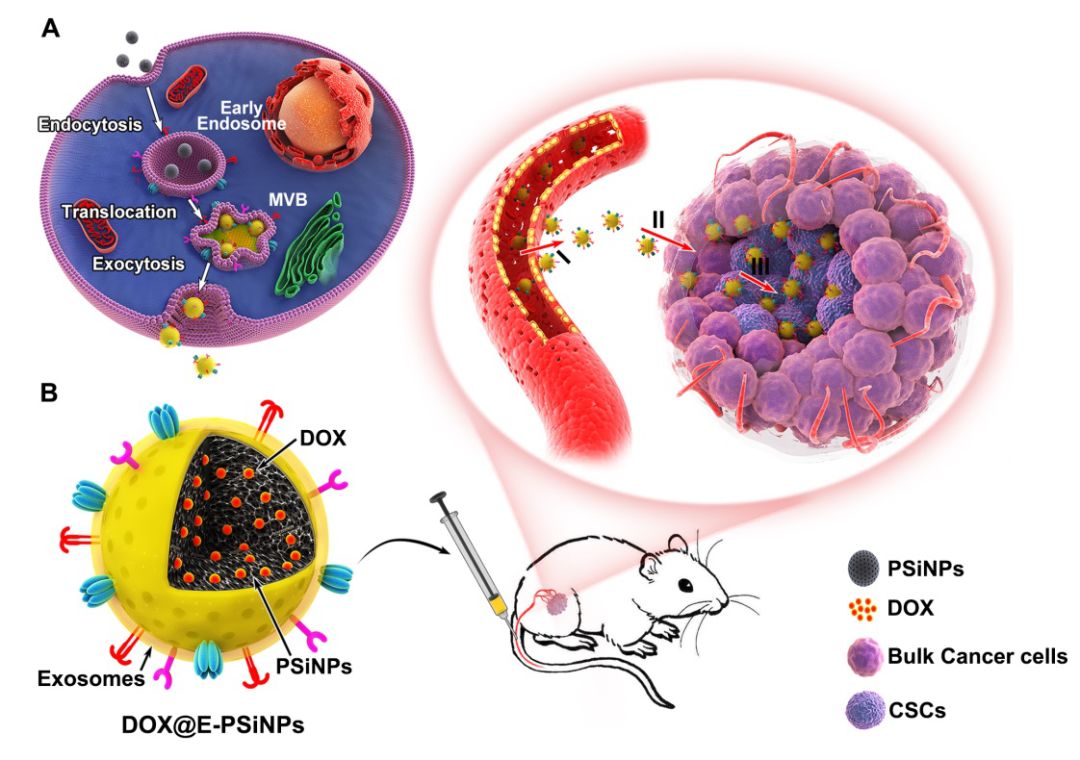
肿瘤干细胞(Cancer stem cells, CSCs)是导致肿瘤复发、转移和耐药的主要原因,发展靶向CSCs的策略是肿瘤临床治疗最有效的策略之一。纳米药物具有增强渗透滞留效应(EPR)、可修饰性、智能响应性以及多种药物共输送等独特的性质,在肿瘤精准协同治疗、增强疗效和降低毒副作用等方面发挥着重要作用。纳米材料常通过偶联靶向分子实现抗肿瘤药物靶向输送,但不同CSCs表达不同的表面标志物,如何将药物高效运送到不同CSCs并发挥作用是目前肿瘤治疗亟待解决的难题。
近年来,杨祥良教授团队提出了抗肿瘤纳米药物靶向输送的“五得原则”:跑得动(Long circulation)、停得下(Tumor targeting)、钻得深(Deep penetration)、进得去(Cellular internalization)、放得出(Drug release)。仿生纳米药物结合天然生物材料的独特功能及人工纳米材料的多功能性特点,在用于药物递送方面引起广泛关注。外泌体(exosomes)是细胞分泌的胞外囊泡,具有长循环、生物相容性好、免疫原性低等优点,更为重要的是外泌体能够表达特定的蛋白,具有“归巢”靶向能力,可被用于药物载体。但构建外泌体仿生纳米药物面临外泌体产量过低、传统超声挤压易导致外泌体蛋白功能丢失进而影响靶向效率等问题。
本研究构建了一种肿瘤细胞外排的外泌体仿生多孔硅纳米粒(E-PSiNPs)用于CSCs的靶向给药。将多孔硅纳米粒与肿瘤细胞孵育,发现肿瘤细胞会通过自噬(autophagy)促进多孔硅外排,且通过免疫荧光、western blot等多种手段鉴定外排的多孔硅表面覆盖着厚约20 nm的外泌体膜结构。相比于传统外泌体分离方式可使其产量提高34倍,且有效保留了外泌体的功能蛋白。E-PSiNPs具有良好的普通肿瘤细胞和CSCs靶向性,且来源于一种肿瘤细胞的E-PSiNPs负载抗肿瘤药物阿霉素后(DOX@E-PSiNPs),表现出对其他不同普通肿瘤细胞和CSCs的交叉摄取与有效杀伤效果,解决了靶向不同CSCs需要偶联不同靶向分子的问题。另外,DOX@E-PSiNPs具有良好的肿瘤组织靶向性、肿瘤血管渗出并穿透至肿瘤深部能力,这些作用与E-PSiNPs表面表达黏附分子CD54有关。基于上述独特的行为,DOX@E-PSiNPs实现了在肿瘤组织内肿瘤细胞和CSCs中的大量蓄积,在肝癌皮下瘤、原位乳腺癌和黑色素瘤肺转移等多种肿瘤模型中均表现出良好的抗肿瘤和杀伤CSCs的能力。该研究为肿瘤细胞来源的外泌体仿生纳米药物用于肿瘤治疗提供了新思路。
华中科技大学生命学院杨祥良教授、甘璐教授及芬兰赫尔辛基大学Helder A. Santos教授为本论文的共同通讯作者,华中科技大学生命学院博士后雍土莹、博士生张晓琼、别娜娜以及芬兰埃博学术大学张宏博博士为该论文共同第一作者。该工作得到了国家重点研发计划和国家自然科学基金等项目的资助。
- 东华大学沈明武研究员/史向阳教授团队 AFM:仿生外泌体伪装的pH响应型树状大分子纳米凝胶作为疫苗通过重编程多种细胞类型治疗胰腺癌 2026-02-20
- 南京大学王炜/曹毅/薛斌团队 Nat. Commun.:仿生分级picot纤维水凝胶涂层实现超低摩擦与高耐磨性 2026-02-09
- 武汉大学刘兴海教授团队《Small》:仿生超韧快速响应水凝胶 2026-02-02
- 北京化工大学王兴教授团队《Adv.Healthc.Mater.》:基于双抗生素的pH响应型无载体纳米药物高效治疗混合细菌感染 2025-08-11
- 中科大王育才/蒋为团队 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破肿瘤血管基底膜屏障,增强纳米药物瘤内递送 2025-05-03
- 川大李旭东/陈君泽、港城大谭超良团队 Adv. Mater.: 多酚-氨基酸缩合物库用于超高载药量纳米药物的高通量连续流生产 2025-02-12
- 浙江大学周民教授团队《Nat. Commun.》:基于微藻的肠道绒毛靶向多级生物系统用于肠易激综合征治疗 2025-08-22
