糖尿病是一种以高血糖为特征的慢性代谢疾病,目前治疗方法主要是皮下注射胰岛素和口服降糖药,但存在频繁注射、胰岛素抵抗、低血糖、血糖失控等问题,给患者带来诸多不便,因此亟需不打胰岛素、不吃降糖药糖尿病新疗法。
2017年,杜建忠教授课题组提出了“以糖控糖”新概念。该课题组设计了一种基于糖聚合物及糖结合蛋白的可“呼吸”糖的囊泡(也称为纳米“糖海绵”),它能在血糖浓度升高时自动“吸入”葡萄糖并存储起来,而在血糖浓度降低时自动“呼出”葡萄糖,从而维持血糖稳定,即“以糖控糖”(J. Am. Chem. Soc. 2017, 139, 7640-7647; C & EN 2017, 95, 9)。
最近,他们又构建了第二代“以糖控糖”囊泡(如图1)。该囊泡是通过苯硼酸糖聚合物PEO-b-P(CMA-stat-AAPBA-stat-AGA)自组装形成的。其中,苯硼酸嵌段AAPBA与葡萄糖及含糖嵌段AGA的动态结合作用赋予了囊泡的吸糖、释糖特性;含糖嵌段AGA还可以增强囊泡的生物相容性;光交联嵌段CMA可延长囊泡的体内循环时间。该囊泡像人工肝脏一样,可实现葡萄糖的动态置换:当外界葡萄糖浓度升高时,囊泡吸入葡萄糖,并将其存储在囊泡中(表现为溶胀);当外界葡萄糖浓度降低时,囊泡释放葡萄糖(表现为收缩)。
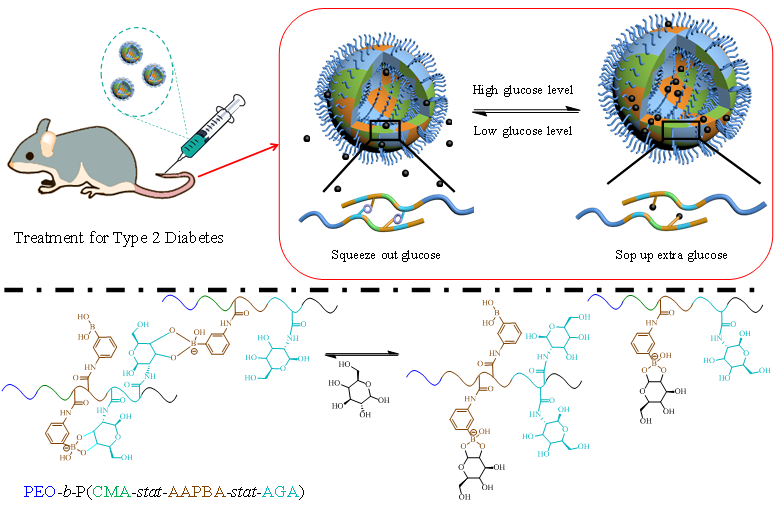
图1. 第二代“以糖控糖”囊泡的设计思想及其血糖调控性能
体外实验表明,该囊泡调控葡萄糖过程中伴随着明显的粒径变化,其摄取和释放葡萄糖的临界浓度约为100 mg / dL,这与正常人血糖水平(70~110 mg / dL)相符合(图2)。
体内实验表明,该囊泡对2型糖尿病小鼠具有良好的长效血糖调控作用,注射一次可维持正常血糖水平30 h,并在70 h内仍有疗效,且具备较低的生物毒性(图3)。
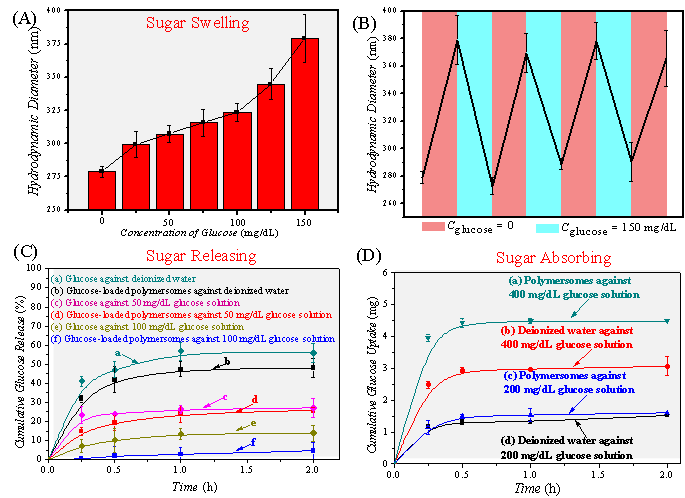
图2. “以糖控糖”囊泡的血糖调控行为
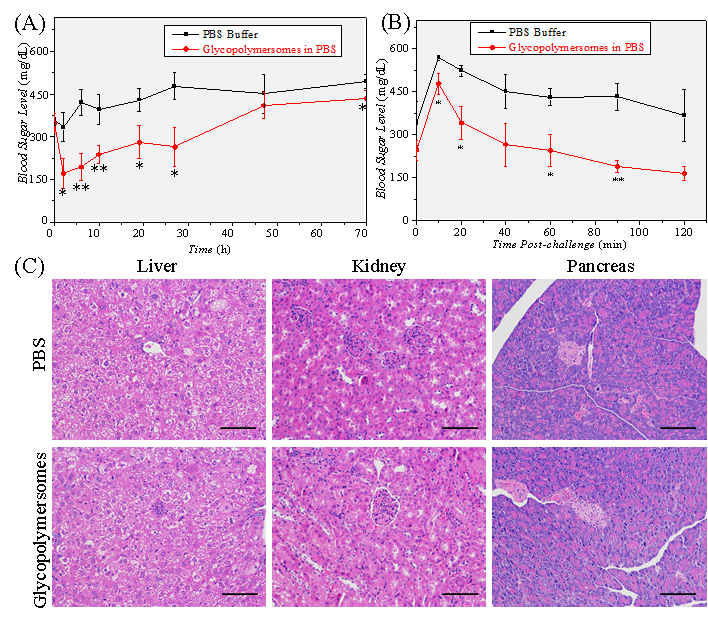
图3. “以糖控糖”囊泡的体内降糖实验及组织切片分析结果
与第一代“以糖控糖”囊泡相比,第二代囊泡不需要糖结合蛋白的辅助,生物相容性得到提升,制备过程也大为简化。
这一成果以“Controlling blood sugar levels with a glycopolymersome(以糖控糖)”为题发表在英国皇家化学会权威期刊《Materials Horizons》(Mater. Horiz. 2019, DOI: 10.1039/C9MH00625G; IF 14.356)上。同济大学博士生萧雨芬和硕士生胡宇是论文的共同第一作者,杜建忠教授为通讯作者。
论文链接:https://pubs.rsc.org/en/content/articlelanding/2019/MH/C9MH00625G#!divAbstract
杜建忠教授课题组主页:https://jzdu.tongji.edu.cn/
- 黄维团队杨震课题组 ACS Nano:超声“开关”调控水凝胶 - 实现糖尿病伤口的逆境重塑 2025-10-17
- 东华大学毛吉富、张倩 AFM:纳米互锁增强电活性敷料 - 电磁感应促进糖尿病伤口愈合和伤口微环境监测 2025-08-08
- 华东理工刘润辉教授与合作者《Bioact. Mater.》:易于制备的抗氧化和抗菌水凝胶薄膜 → 快速止血和促进感染性糖尿病创面愈合 2025-07-31
- 河南大学《Adv. Sci.》:高分子囊泡弹性对脑肿瘤靶向影响研究新进展 2021-09-02
- 同济大学杜建忠教授提出 “酸诱导吸附”和“亲和强化吸引”原理以高效包载生物大分子 2020-05-15
- 同济大学杜建忠教授课题组提出氨基酸环内酸酐开环聚合诱导自组装(NCA-PISA)新方法 2019-09-17
