抗肿瘤纳米药物具有广泛和迫切的需求,但目前的临床用纳米药物只能降低药物的毒副作用,在疗效上与原药相比未有显著改善。因此,进一步设计创新载体以提高负载药物的疗效是目前纳米药物输送领域亟待解决的问题。
2019年7月1日,浙江大学申有青教授团队和加州大学洛杉矶分校(UCLA)顾臻教授团队合作在Nature Nanotechnology杂志上发表了题为 Enzyme-activatable polymer–drug conjugate augments tumour penetration and treatment efficacy的研究论文,提出了纳米药物在肿瘤组织中主动渗透新机制,有望解决纳米药物在实体瘤中渗透难的瓶颈问题,并用多种动物模型验证了其在体内显著的抑瘤效果。
肿瘤靶向纳米药物的体内输送过程是一个包括从血液循环系统(Circulation)向肿瘤组织内蓄积(Accumulation)、在瘤内渗透扩散(Penetration)以被肿瘤细胞内吞(Internalization)、然后在胞内将药物释放(Release)的五步"CAPIR级联"过程 (circulation, accumulation, penetration,internalization and release)。这种串联过程的特点使每步都有高的输送效率成为纳米药物获得高疗效的关键,但纳米药物在肿瘤组织内难以渗透扩散是其最大的难题。
肿瘤内部缺少毛细血管网,有非常致密的细胞外基质和非常高的细胞密度,因此即使是小分子溶质也难以从瘤内扩散出来,也由此导致了瘤内高的渗透压。这些肿瘤组织微环境的特点使氧气这种很小(0.346 纳米)的分子在瘤内也只能扩散100-200 微米处(一到两根头发的直径),药物分子(几个纳米)在肿瘤组织内的扩散已经非常有限,相对来说体积巨大(粒径一般在几十甚至上百纳米)的纳米药物在瘤内也就难以移动。因此,纳米药物自身大尺寸的因素和肿瘤组织结构特点导致了目前临床用纳米药物即使能够蓄积在瘤内,也难以在瘤内渗透扩散开来到达血管远处的肿瘤细胞,也就无法完成输送过程的入胞和胞内释放两步,导致疗效不理想,这也是众多新开发的纳米药物临床实验失败的重要原因。
针对上述问题,国内外研究者进行了大量的探索工作,如降低肿瘤组织密度、减小纳米药物尺寸以降低纳米药物在瘤内的渗透阻力,表面修饰可促进组织渗透的功能基团等工作,虽然能在一定程度上提高纳米药物在肿瘤组织内的渗透能力,但大尺寸的纳米药物要在致密的肿瘤内依靠自身的扩散进行被动渗透的机理没有变,渗透扩散困难的“天然短板”依然存在。
在最新的这项研究中,研究人员巧妙地利用了肿瘤内细胞密度高的特点、让它们“主动地”在细胞间传递纳米药物:即让细胞从一边吞噬纳米药物,然后从另一边将一些纳米药物排到细胞间液中(即胞吞转运作用),让邻层的细胞重复内吞和外排,从而实现不依赖扩散的纳米药物跨细胞传递,即“主动”肿瘤渗透。实现这一设想的必要条件是纳米药物能够被快速内吞。大量的工作表面带正电的纳米药物具有快速细胞内吞的能力,但关键是如何使血液循环系统中呈电中性的或者电负性的纳米药物只在肿瘤的毛细血管内、或外渗进入肿瘤组织后就立即带上正电,以触发上述快速细胞内吞和主动肿瘤渗透。
为此,本文作者利用肿瘤血管的内皮细胞上及血管附近肿瘤细胞高表达γ-谷氨酰转肽酶(GGT)的特点,设计合成了GGT响应性的聚合物PBEAGA及其与化疗药物喜树碱(CPT)的偶联物PBEAGA-CPT。PBEAGA以离子对型的γ-谷氨酰基为侧基,因而具有高水溶性和电中性及与金标准聚乙二醇(PEG)相当的长血液循环时间。到达肿瘤部位之后,细胞表面的GGT水解掉聚合物上的γ-谷氨酰基而产生胺基,使聚合物带上正电荷,促使血管表皮细胞或者肿瘤细胞快速内吞阳离子化的偶联物,进而触发转胞吞作用和在肿瘤组织内的跨细胞传递(图1a)。体内渗透实验表明,纳米药物经尾静脉注射十分钟后,PBEAGA-CPT的红色荧光就已经外渗出肿瘤毛细血管并遍布整个肿瘤区域,不到一小时后整个肿瘤组织内的药物浓度就和肿瘤血管内的浓度相当(图1b)。可见,这种依赖细胞耗能的内吞/外排的主动渗透策略能赋予纳米药物在实体瘤中快速渗透分布的能力。
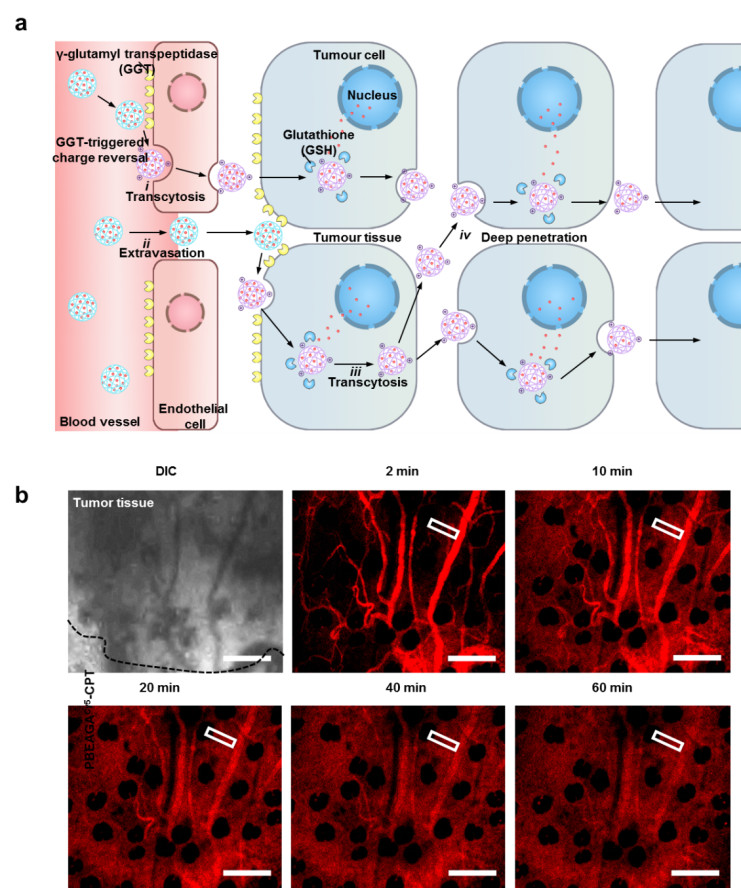
图1(a) PBEAGA-CPT在肿瘤组织中的主动渗透机理图;(b)激光共聚焦实时监测PBEAGA-CPT在肿瘤组织中的渗透情况
最后,研究者用多种动物模型考察了PBEAGA-CPT在体内的抑瘤效果,结果表明,尾静脉注射的PBEAGA-CPT不仅能完全治愈起始体积为100立方毫米的小肿瘤(图2a),而且对于难以治疗的、已处于指数增长、达500立方毫米大肿瘤,尾静脉给药后肿瘤体积迅速萎缩变得很小,停药半月后也未见明显反弹,抑瘤率高达98%(图2b)。最后研究者还挑战了号称癌症之王的“胰腺癌”,建立了胰腺癌原位模型,发现与临床一线药物吉西他滨相比,PBEAGA-CPT显著抑制肿瘤的生长而大大延长了实验小鼠的存活期(图2c)。

图2 PBEAGA-CPT在多种动物模型中的抑瘤效果图
值得一提的是,这种化被动渗透为主动渗透的策略,使纳米药物避开了肿瘤组织致密微环境构成的天然生物屏障,克服了纳米药物大尺寸导致扩散能力低的天然缺陷,有望解决纳米药物在肿瘤组织内渗透难的问题,为下一阶段纳米药物的设计开辟了新的思路。下一步,研究者将在人源动物模型中进一步验证其抑瘤效果,为潜在应用于临床做好准备。同时研究者也在尝试利用类似的方法输送其它抗肿瘤药物、将延展其成为平台化技术的可能。
值得一提的,Nature Nanotechology杂志同期还发表了题为Transcellular transfer of nanomedicine的News & Views的评论文章,对上述工作进行了highlight。
原文链接:https://www.nature.com/articles/s41565-019-0485-z
本文经授权转载自微信公众号BioArt。
- 北京化工大学王兴教授团队《Adv.Healthc.Mater.》:基于双抗生素的pH响应型无载体纳米药物高效治疗混合细菌感染 2025-08-11
- 中科大王育才/蒋为团队 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破肿瘤血管基底膜屏障,增强纳米药物瘤内递送 2025-05-03
- 川大李旭东/陈君泽、港城大谭超良团队 Adv. Mater.: 多酚-氨基酸缩合物库用于超高载药量纳米药物的高通量连续流生产 2025-02-12
- 福建师大杨震/张先增、西工大黄维 Adv. Sci.:极化调控与界面缺陷工程协同增强光-热释电效应 - 助力肿瘤治疗 2026-03-01
- 天工大高辉/余云健团队 ACS Nano:创新纳米酶精准消除肿瘤胞内菌 助力结直肠癌免疫治疗突破 2026-02-20
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
- 浙江大学周民教授团队《Nat. Commun.》:基于微藻的肠道绒毛靶向多级生物系统用于肠易激综合征治疗 2025-08-22
