近红外光激发的光热治疗可以有效弥补传统癌症治疗手段的不足。但是目前常用的近红外有机光热分子(如花菁类等)的光稳定性差,其光降解会影响纳米结构的稳定性和光热转化效率。因此,开发一种兼具高稳定纳米结构和高光热转化效率的新型近红外有机光热试剂,将有效提高肿瘤的治疗效率及医学安全性。
近日,北京化工大学尹梅贞教授课题组报道了水溶性近红外莱啉系光热分子Quaterrylenediimide(QDI),其具有较高光热转化效率(64.7 ± 4%)以及近红外吸收的特性(808 nm),重点研究了其光诊疗(光声成像和光热治疗)性能,并进一步评价了其癌症治疗应用以及生物安全性。该课题组前期曾报道以莱啉系Terrylenediimide(TDI)、Perylenediimide(PDI)为核的光热试剂,分别发表于ACS Nano (2017, 11, 3797–3805)及Sci Bull (2018, 63, 101-107) 等杂志。
该工作发表于Angew. Chem. Int. Ed.,题为“A Water-soluble, NIR-absorbing Quaterrylenediimide Chromophore for Photoacoustic Imaging and Efficient Photothermal Cancer Therapy”,DOI: 10.1002/anie.201810541 & DOI: 10.1002/ange.201810541。北京化工大学博士生刘畅为第一作者,尹梅贞教授为通讯作者。
如图1所示,通过拓展Perylenemonoimide(PMI)分子的π-共轭度制备QDI,具有近红外吸收(600 nm-1000 nm),运用大分子修饰策略,在“核”周围引入拓扑结构水溶性“外壳”PEG,提高生物相容性及延长体内循环时间。在亲疏水及π-π作用力驱动下,QDI大分子可以在水溶液中自组装成超小纳米胶束(10.8 ± 1.4 nm),有利于肿瘤组织深层渗透及体内有效代谢。在激光照射后实现高效的光热升温性能,在生物实验中,表现出优异的光声信号,高效的光热治疗效果及可靠的生物安全性。
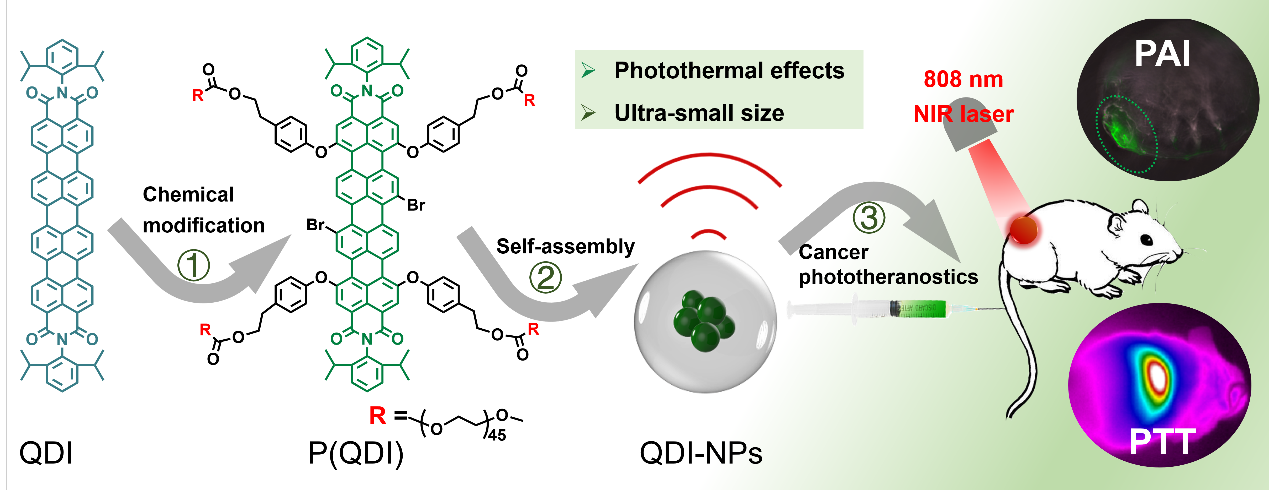
图1 光诊疗试剂QDI-NPs的设计思路
在近红外808 nm激光辐射下,QDI具有比大多数有机光热试剂高的光热转化效率64.7±4%。随后在细胞及活体水平验证了QDI作为一种新型近红外光热分子对癌症的光声成像和光热治疗效果。QDI-NPs被动靶向到小鼠肿瘤组织过程中,通过光声成像监测药物在肿瘤组织的代谢动力学问题,并成功实现了肿瘤位置,形状,尺寸等信息的可视化。在最佳药物富集时间实施激光治疗后,小鼠在观察期内,完全治愈并且恢复健康,见图2。

图2 光诊疗试剂QDI-NPs的性能表征及生物应用
(A)不同浓度的QDI-NPs在PBS中的光照升温曲线。
(B)QDI-NPs与细胞共培养的光照毒性。
(C)光热治疗后各组分小鼠肿瘤照片。
(D)尾静脉注射QDI-NPs后,不同时间小鼠肿瘤组织光声信号强度图片(左)及36h肿瘤组织3D光声信号图片(右)。
他们制备的QDI光热纳米药物具有以下三个特点:
1、超小、可控且稳定的纳米结构和高生物相容性,有利于肿瘤组织深层渗透和从体内有效代谢;
2、近红外吸收及高的光热转化效率,能穿透更深层组织及降低药物剂量和激光辐射对生物体带来的二次损害;
3、优异的光稳定性及较强的光声信号,可实现肿瘤的光诊疗一体化研究。
该研究工作不仅为开发新型有机光热试剂提供了思路,还丰富了现有光热试剂的种类,为科学研究和临床使用提供了更多的选择和借鉴。
文章信息:
1. Chang Liu,Shaobo Zhang, Jianhao Li, Jie Wei, Klaus Müllen and Meizhen Yin*, A Water-soluble, NIR-absorbing Quaterrylenediimide Chromophore for Photoacoustic Imaging and Efficient Photothermal Cancer Therapy, Angew. Chem. Int. Ed., DOI: 10.1002/anie.201810541
2. Shaobo Zhang, Jianhao Li, Jie Wei, Meizhen Yin*, Perylenediimide Chromophore as An Efficient Photothermal Agent for Cancer Therapy, Sci. Bull., 2018, 63(2): 101-107.
3. Shaobo Zhang, Weisheng Guo, Jie Wei, Chan Li, Xing-Jie Liang*, and Meizhen Yin*, Terrylenediimide-Based Intrinsic Theranostic Nanomedicines with High Photothermal Conversion Efficiency for Photoacoustic Imaging-Guided Cancer Therapy, ACS Nano, 2017, 11 (4): 3797–3805.
文章链接:
https://onlinelibrary.wiley.com/doi/full/10.1002/anie.201810541
https://pubs.acs.org/doi/abs/10.1021/acsnano.6b08720
https://www.sciencedirect.com/science/article/pii/S2095927317306345
- 上科大叶春洪课题组 AFM:高不对称性近红外圆偏振长余辉材料及信号动态调控 2026-01-08
- 北林许凤/湖北工大冯清华 Nat. Commun.:木质素不再是累赘 - 木材煮一煮,光谱挑一挑,助力高近红外选择性木基滤光片 2025-11-29
- 东华大学王宏志教授/李克睿研究员团队 Nat. Commun.:聚集增强近红外调制的高稳定近零透过率电致变色窗 2025-11-17
- 郑州大学姚伟睛/魏从/刘旭影 AFM:基于光热触发自修复聚氨酯弹性体的多功能热致变色荧光装置 2026-02-28
- 仿生“阴阳耦合”+ 多尺度纳米限域效应!上海交大黄小彬团队 AFM:研发高性能光热滑爽聚脲防除冰涂层-为户外设备抗冰提供新思路 2026-01-31
- 港城大吕坚/新国大Tan Swee Ching/太原理工王美玲 Nat. Commun.:用于可逆海水提锂的吸附响应式光热离子泵 2025-10-11
- 北京化工大学王兴教授团队《Adv.Healthc.Mater.》:基于双抗生素的pH响应型无载体纳米药物高效治疗混合细菌感染 2025-08-11
