粘土矿物埃洛石纳米管(Halloysite Nanotubes, HNTs),是一种具有中空管状结构、良好水分散性、内外壁不同性质、高吸附性、生物相容、环境友好的新型纳米材料。天然埃洛石的内径为10-20 nm,外径为40-70 nm,长度为200-1000 nm,化学式为Al2Si2O5(OH)4。由于其具有高长径比和高吸附性,能够在其管内外壁吸附或接枝功能分子,因此在药物载体、组装工程支架和生物检测等领域具有潜在应用。
近年来,暨南大学刘明贤教授研究团队在埃洛石的生物医学应用方面取得了系列的研究进展。
1. 埃洛石作为组织工程支架的增强材料。利用埃洛石的高长径比、良好的分散能力和生物相容性,将埃洛石作为聚乳酸、壳聚糖、海藻酸钠、纤维素等医用聚合物的增强材料,通过溶液混合、冷冻干燥、沉析凝胶、静电纺丝等方法制备了纳米复合生物材料。研究发现埃洛石能有效地提高生物材料的力学性能,埃洛石与高分子之间存在较强的界面作用,系统评价了埃洛石及其复合材料的细胞相容性,提出了无机纳米管促进细胞黏附增殖、止血和伤口愈合的机制(Progress in polymer science, 2014, 39(8):1498, ESI高被引论文; Journal of Materials Chemistry B, 2013, 1: 2078, ESI高被引论文; RSC Advances, 2014, 4(45): 23540; Materials Science and Engineering: C, 2015, 49: 700; 2017, 70: 303; Carbohydrate polymers, 2017, 175: 689)。埃洛石的外观和微观形态见图1。

图1 埃洛石的外观和微观形态
2. 埃洛石作为抗癌药物载体。通过壳聚糖、壳寡糖、PEG、聚醚酰亚胺、树枝状高分子的修饰,提高了埃洛石的细胞亲和性以及摄入能力,赋予了纳米载体的肿瘤细胞靶向性,降低了溶血率。埃洛石可以负载姜黄素、阿霉素、DNA及siRNA进入细胞。埃洛石的作用在于可以缓慢地释放药物,延长药物作用时间,同时也提高了药物进入肿瘤细胞的效率。与其他粒子进入细胞的途径不同,携带药物的埃洛石可以通过直接针入和细胞胞吞两种方式跨膜进入肿瘤细胞。由于接枝了靶向基团,这种纳米药物平台对正常细胞和组织几乎没有伤害。通过肿瘤原位注射、静脉注射化疗/基因药物,发现埃洛石纳米载体可以有效降低药物的器官毒性,能更好地抑制肿瘤生长,荷瘤老鼠在60天内未发现有死亡。该系列工作是国内外首次将埃洛石作为抗癌药物载体的研究扩展到实体动物水平。(Journal of Materials Chemistry B, 2016, 4(13): 2253; ACS Applied Materials & Interfaces, 2016, 8 (40): 26578; ACS Applied Nano Materials, 2018, 1(2): 595; Bioconjugate Chemistry, 2018, DOI: 10.1021/acs.bioconjchem.8b00321)。埃洛石表面接枝壳寡糖以及负载DOX抗癌药物进入细胞及对肿瘤的抑制作用的示意图见图2。
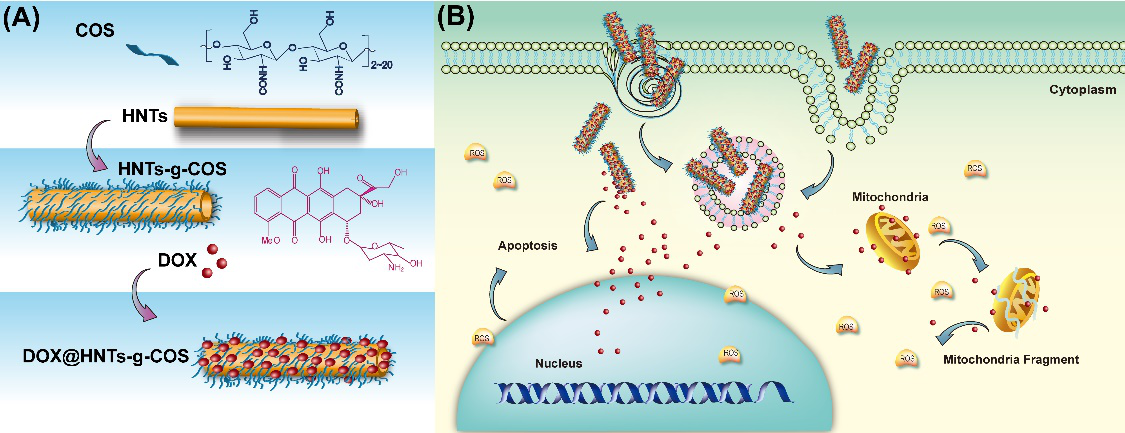
图2 埃洛石表面接枝壳寡糖(A)和负载DOX抗癌药物进入细胞及对肿瘤的抑制作用(B)示意图
3. 埃洛石作为生物检测器件。该团队首先利用聚苯乙烯磺酸钠改性埃洛石,有效地改善了其在水中分散稳定性。之后巧妙利用毛细管、夹片受限空间、球板受限空间等方式将埃洛石进行干燥过程取向排列,利用重力、摩擦力和表面张力的力学平衡原理,进行多次的粘附-脱粘过程。最终获得了在多种基底上形成的纳米阵列条纹,条纹中的纳米管也呈现一定程度的取向排列,而且在偏光下显示出规则的马耳他十字现象,非常类似聚合物球晶和液晶的光学折射现象(图3)。通过改变分散液的浓度、干燥温度、剪切力条件等,可调控形成的图案结构。制备的埃洛石规则条带结构表面可以捕获循环肿瘤细胞,也能作为引导细胞取向的基底(ACS Applied Materials & Interfaces, 2016, 8(12): 7709)。进而,在狭缝和球-板受限空间中制备了具有可控纳米管取向排列和条带状和同心圆环状的图案化表面 (Journal of Materials Chemistry B, 2017,5(9): 1712; Langmuir, 2017, 33(12): 3088),两篇论文均入选封面论文(图4),其中JMCB的论文入选2017年度HOT Papers。通过喷枪喷涂方法可以制备具有半透明的埃洛石粗糙表面,其具备超疏水和油水分离性能(Chemical Engineering Journal, 2018, 331: 744)。
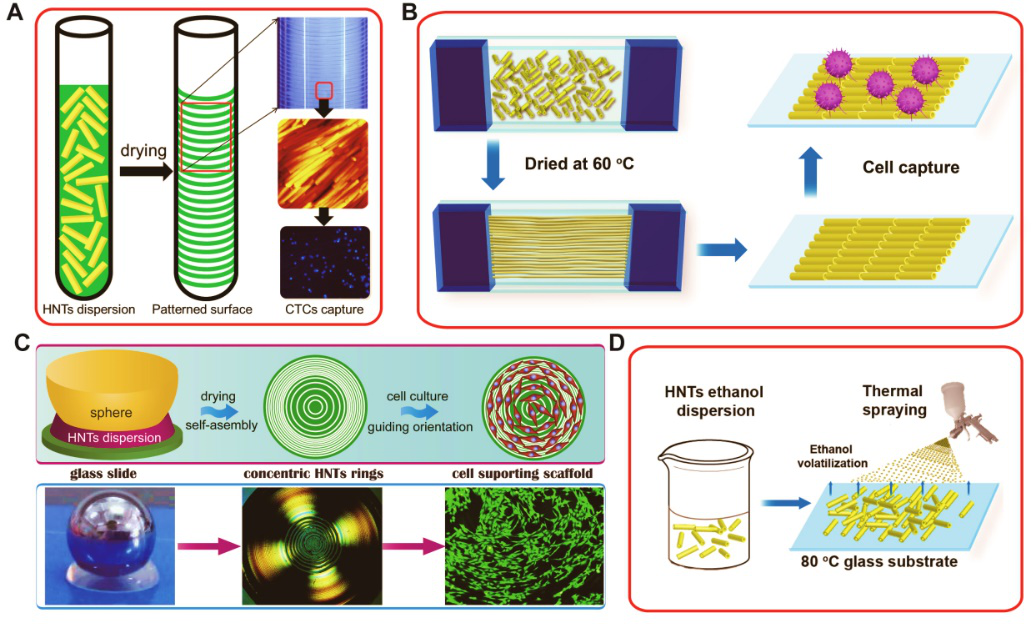
图3 在不同的受限空间中埃洛石的组装及有序结构形成和应用:(A) 玻璃管;(B) 狭缝;(C)球-板;(D) 热喷涂

图4 该团队发表在JMCB(左)和Langmuir(右)杂志的论文入选杂志封面
由于纳米埃洛石和癌细胞之间存在强相互作用,该团队研究发现,HepG-2、MCF-7、Neuro-2a、A549等癌细胞在埃洛石粗糙表面上的捕获率均高于80%。与EpCAM抗体偶联后可将癌细胞的捕获率在3小时内提高到92%。表面可从加入肿瘤细胞的血液中以及临床癌症病人血液高效率捕获并杀死癌细胞,从而成为早期诊断和病情监控的纳米诊疗平台。进一步研究发现,埃洛石能够数量级地增强金基底的拉曼散射信号,能够提高对牛血清蛋白的检测能力。这表明埃洛石在多种生物检测领域的应用潜力,从而可能实现重大疾病的生物信号体外检测和靶向治疗(ACS Applied Materials & Interfaces, 2018, 10 (6): 5933; Materials Science and Engineering: C, 2018, 85: 170),见图5。
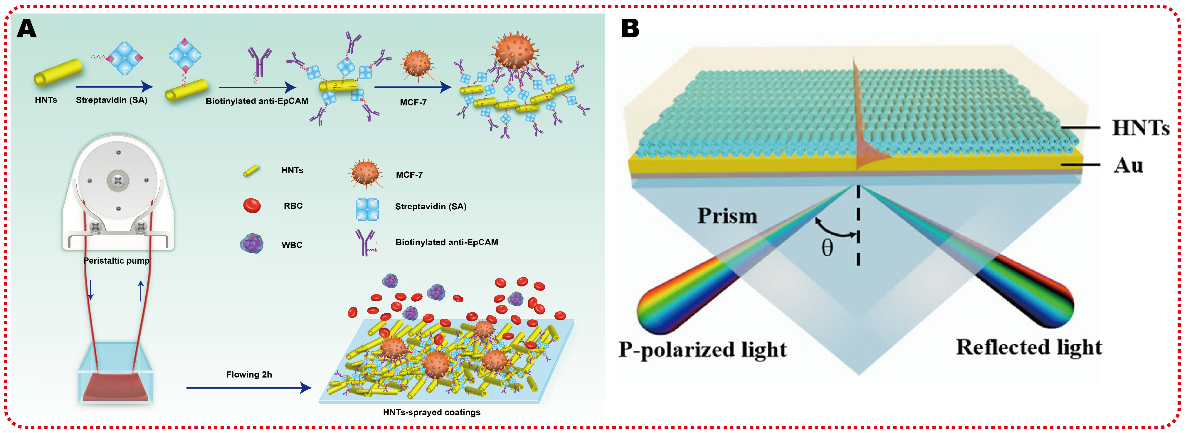
图5埃洛石表面用于动态捕获循环肿瘤细胞(A)和表面等离子体共振器件(B)的示意图
4.埃洛石的生物安全性研究。随着越来越多的含埃洛石的工业化产品进入环境,以及埃洛石基的药物载体的开发应用日益增多,埃洛石在环境中的生物毒性问题引起了全世界范围内的重视。该团队用细胞和斑马鱼模型对埃洛石的体内和体外毒性进行了研究。为了清晰地观察埃洛石在斑马鱼体内的分布代谢情况,埃洛石用异硫氰酸荧光素(FITC)进行了标记。细胞毒性实验、细胞凋亡法和活性氧测试法都表明埃洛石对人体正常细胞和癌细胞都具有很好的相容性。当埃洛石 (200 μg/mL)与细胞培育72小时后,细胞的活性依然高于60%。激光共聚焦显微镜观察到FITC-埃洛石被细胞摄入的情况。斑马鱼模型实验表明不同浓度的埃洛石对斑马鱼胚胎和幼体没有急性毒性,同时浓度小于25 mg/mL的埃洛石还能促进斑马鱼的孵化。电镜实验观察到埃洛石能富集在斑马鱼胚胎卵膜上,但对斑马鱼胚胎没有毒副作用(图6)。动物实验结果表明,埃洛石被斑马鱼吞食后主要分布在其胃肠道,有趣的是该论文直接观察到了埃洛石能被斑马鱼排泄出去的证据(图6)。因此埃洛石是一种环境友好型的纳米材料,它在各个领域的应用是相对低毒安全的。该研究发表在Journal of Materials Chemistry B杂志的2018 Emerging Investigators专刊上(2018, DOI: 10.1039/C8TB01382A)。该杂志介绍,2018 Emerging Investigators专刊突出了2018年世界范围内材料化学研究的新星。该期杂志收集了材料化学家在其独立职业生涯早期阶段的最佳工作。该期的每篇论文都是由其所在领域的专家推荐发表的,这些工作有可能影响材料化学的未来发展方向,杂志认为论文作者也是迄今为止在生物学和医学材料领域开展重要工作的研究者。

图6 埃洛石遇上斑马鱼:埃洛石包裹在鱼卵外层的照片以及埃洛石在斑马鱼胃肠道分布和排泄过程照片
这些研究得到了科技部863计划青年科学家课题、国家自然科学基金、广东省自然科学杰出青年基金、广东省特支计划、广州市珠江科技新星和暨南大学双百英才计划的资助。
以上相关论文链接请查阅:http://m.jnulmx.icoc.cc/cn/nd.jsp?id=92
- 陕科大王学川/刘新华 AFM:埃洛石纳米管与天然皮肤的界面分子调控 - 用于先进辐射冷却与能量收集的仿生可穿戴材料 2025-11-17
- 暨大刘明贤教授团队 Compos. Sci. Technol.:基于PVA双层膜的具有结构色的湿响应智能传感器 2023-06-17
- 暨南大学刘明贤教授课题组:定向孔结构壳聚糖/胶原/埃洛石复合止血敷料 2023-04-04
- 澳门大学姜颖课题组诚招博士后、博士生、研究助理 - 柔性器件方向(高分子材料/电子/生物医学工程等) 2026-01-24
- 北京大学雷霆课题组诚聘博士后/科研助理 - 化学合成、柔性电子、生物医学工程、脑机接口等 2026-01-16
- 华科大李子福教授 Nat. Commun.:相变纳米凝胶赋能生物医学新突破 2025-12-22
