由两亲性分子自组装形成的囊泡结构,包括脂质体囊泡(liposome)和聚合物囊泡(polymersome),因其类似于细胞的双分子层膜结构,高效的负载能力和可功能化特性而在药物控释领域受到广泛关注。具备控制释放能力的囊泡常常通过引入具有化学刺激响应性的分子,在相应的化学刺激(如pH变化、氧化还原等)下发生降解、亲疏水性转变或共价键断裂等行为来实现,但这一类方法在应用到癌症治疗时往往要求持续性地改变肿瘤组织周边化学环境,这会导致体系化学污染和正常细胞损伤。通过对两亲性分子的结构和在双分子层内的排布方式进行控制和设计,我们也可以获得具有物理刺激响应性的囊泡。物理刺激具备远程、定点调控的优势,在避免误伤正常细胞的同时实现精准高效可控的药物释放。

图1. 因膜内晶相或液晶相而形成特殊结构的各类脂质体囊泡和聚合物囊泡
来自法国国家科学研究中心(CNRS)与巴黎高科化学学院(Chimie ParisTech)联合实验室的李敏慧教授课题组从囊泡膜内的分子排布着手,阐述了双分子层内晶相或液晶相结构如何影响囊泡的形貌,以及双分子层内相转变如何引发囊泡的形貌变化乃至破裂,系统性地整理并介绍了各类能够对温度、光照、剪切力、电场等物理刺激做出智能性响应、从而实现药物可控释放的脂质体囊泡和高分子囊泡。基于热刺激响应的脂质体药物ThermoDox®结合热疗(thermal therapy)的癌症治疗手段已经进入了第三期临床试验并取得了可喜的成果。ThermoDox®的囊泡主要由两种不同结构的磷脂分子组成,在常温下形成类似足球状的具有块状晶区(crystalline domain)和晶界(grain boundary)的膜结构,它在热疗作用下能够选择性地在肿瘤组织聚集,并在相转变温度(Tm = 39?42 °C)下发生晶界的预熔解形成缺陷,从而实现快速的药物释放(图2)。从ThermoDox®开始,综述逐一讨论了近年来科学家们对于利用膜内相转变实现物理刺激响应性囊泡的最新研究成果。从具有晶相的剪切力响应性脂质体囊泡,到膜内结晶的热响应性高分子囊泡,再到双分子层具有液晶相的高分子囊泡。
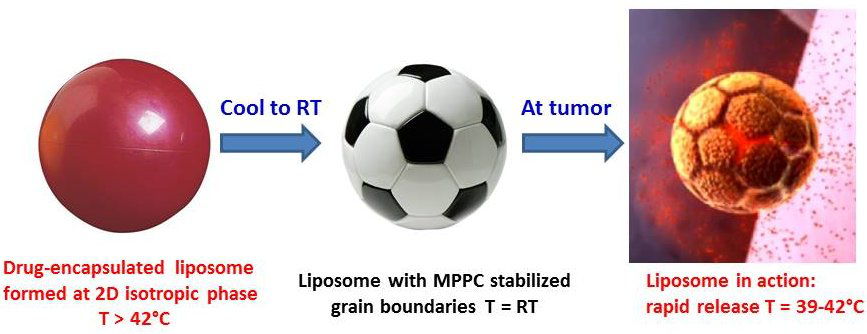
图2. ThermoDox®囊泡的假想结构及其热响应释药机制
自2005年开始,李敏慧教授课题组通过将液晶分子引入聚合物侧链,系统性的研究报道了含有液晶性高分子的两亲性嵌段共聚物通过自组装形成的囊泡结构。一种分别由含横挂偶氮苯液晶分子的聚甲基丙烯酸酯(PMAzo)和聚丁二烯(PBD)构成内外两侧分子层(ePBD-iPAzo)的聚合物囊泡具有光刺激响应能力。在360 nm紫外光照刺激下,内侧聚合物分子因发生“向列相液晶?各向同性”的相转变而导致内侧分子层面积增加,外侧分子层则维持不变。这种不平衡而产生的自卷曲率导致了孔洞在缺陷处迅速形成,并且随着双分子层向外卷曲而扩张(图3)。这一光响应性变化能够在几百毫秒内迅速完成。另一类含有竖挂型侧链液晶高分子的聚合物囊泡则因为其近晶相液晶分子的层状排布方式,倾向于形成多面体或椭球形的结构,这样的结构存在类似于ThermoDox®囊泡的相边界和缺陷,具备对剪切力或热刺激进行响应的潜在特性。
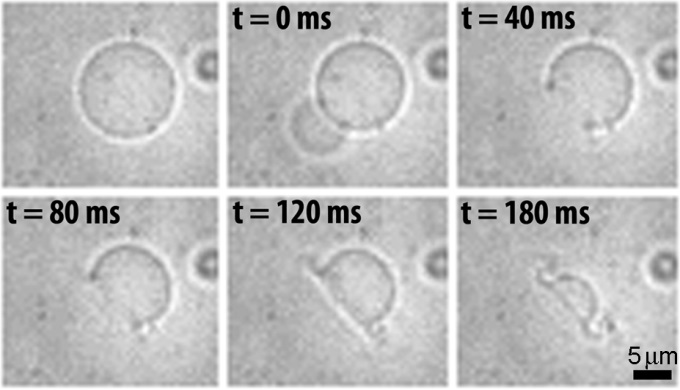
图3. ePBD-iPAzo囊泡在360 nm紫外光刺激下从形成孔洞到孔洞随着双分子层向外卷曲而扩张的全过程。在t = 0 ms孔洞形成时可以看到囊泡内蔗糖水溶液的释放;进行到t = 180 ms时囊泡已几乎完全崩解。
基于对上述研究成果的整理和讨论,作者最后对刺激响应性聚合物囊泡作为智能药物载体的未来作了展望。从对脂质体囊泡膜结构内相转变的报道(1973),到第一种具有热刺激响应性的脂质体药物ThermoDox®进入临床研究(2014),经过了科学家们四十余年的不懈努力。而对聚合物囊泡的研究仅始于上世纪末,因此我们应该有信心预见在不远的将来看到刺激响应性聚合物囊泡应用于癌症、心血管疾病等的高效诊断和药物治疗中。
综述发表在Nanoscale (Nanoscale, 2018,10, 6781-6800),第一作者是浙江大学高分子系博士生邓扬威,他曾受到中国国家留学基金委的资助到巴黎李敏慧教授课题组进行合作研究。
论文链接:http://pubs.rsc.org/en/Content/ArticleLanding/2018/NR/C8NR00923F
