耐药阴性菌感染死亡率高,且近50年来未有新类别抗生素问世,因此亟需开发新型抗菌药物应对这一全球公共卫生威胁。宿主防御肽(HDPs)及其模拟物因其不易诱导耐药性的优点,被视为极具前景的抗耐药菌感染候选药物,但在体内环境中可能会与宿主细胞和负电荷生物大分子等发生非特异性相互作用,进而引发溶血毒性等问题。因此,设计兼具高效体内活性和良好生物相容性的HDP模拟抗菌化合物,对于耐药细菌感染治疗具有重要意义。
本研究中,刘润辉教授课题组提出“感染病灶原位响应抗菌聚合物前药”策略。该策略通过2,3-二甲基马来酸酐修饰聚合物侧链氨基,屏蔽其正电荷,从而显著提高生物相容性并延长血液循环时间;在感染病灶的酸性微环境中,前药可被激活并恢复正电荷,实现精准抗菌和病灶部位富集。此外,这一设计还显著拓宽了HDP类抗菌化合物的体内应用潜力,可将原本因毒性等问题受限的抗菌化合物转化为安全有效的治疗候选药物,大幅提高了抗菌药物的开发效率。基于此策略设计的HDP模拟聚(2-噁唑啉)前药在皮下脓肿、中性粒细胞减少大腿感染、肾脏感染、肺部感染及腹膜炎等多种动物感染模型中均展现出优异的治疗效果,且长期使用未诱导耐药性产生。该研究为设计新型抗菌药物和治疗耐药微生物感染提供了创新策略。

2025年6月4日,该研究成果以“A host defense peptide-mimicking prodrug activated by drug-resistant Gram-negative bacterial infections”为题发表在Science Translational Medicine,并被选为正封面文章(Sci. Transl. Med. 2025, DOI: 10.1126/scitranslmed.adl4870)。
耐药细菌感染因其发病率和死亡率高,已成为威胁人类生命健康的重大公共卫生问题。其中革兰氏阴性菌是最棘手的临床问题之一,也是耐药性感染死亡的主要原因。然而,由于阴性菌具有高度不可渗透的外膜屏障,导致针对阴性菌的候选药物相对较少,且近50年来未能发现新类别抗生素。宿主防御肽及其模拟物具有广谱抗菌活性和不易诱导微生物产生耐药性的独特优势,是解决耐药菌感染最有前景的治疗候选药物之一。然而,在复杂的体内环境中,这些HDP类活性分子可能会与红细胞等具有多阴离子膜结构的宿主细胞以及血清蛋白等多阴离子大分子发生非特异性相互作用,从而导致体内抗菌活性降低、溶血毒性等。这一长期存在的科学挑战,促使设计兼具高体内活性和生物相容性的新型抗菌药物,以治疗全身性耐药微生物感染。
刘润辉教授课题组在前期研究中,提出了以优异生物安全性的聚噁唑啉(多肽主链上酰胺键转移至侧链)模拟天然多肽,创新性地实现了基于聚噁唑啉骨架的功能性多肽模拟,发现了体内外高效抗耐药细菌和耐药真菌的聚噁唑啉活性分子(Angew. Chem. Int. Ed. 2020, 59, 6412,VIP论文,ESI高被引;Angew. Chem. Int. Ed. 2022, 61, e202200778,VIP论文;J. Am. Chem. Soc. 2023, 145, 25753,JACS Spotlight;Nat. Microbiol. 2024, 9, 1325, ESI高被引)。本研究报告了一种 “酸响应抗菌聚合物前药”策略,并使用聚(2-噁唑啉)进行了概念治疗验证。通过用 2,3-二甲基马来酸酐保护侧链氨基以屏蔽正电荷,聚(2-噁唑啉)前药可以在生理条件下隐形,并在感染部位激活。该前药具有出色的生物相容性和延长的血液循环时间,对耐药阴性菌和生物被膜具有高活性,并在多种局部和全身感染动物模型中展现出优异的治疗效果(图1)。

图 1:设计感染部位pH响应型抗菌聚合物前药。
本研究首先通过2-噁唑啉单体共聚合成了不同亲/疏水比例的HDP模拟聚噁唑啉分子库,并探究了一系列聚噁唑啉的抗革兰氏阴性菌活性和哺乳动物细胞以及血红细胞毒性。其中疏水性比例为70%的聚噁唑啉对多种阴性菌包括铜绿假单胞菌、大肠杆菌、鲍曼不动杆菌和肺炎克雷伯菌均表现出高效抗菌活性,同时具有较好的生物相容性(图2)。
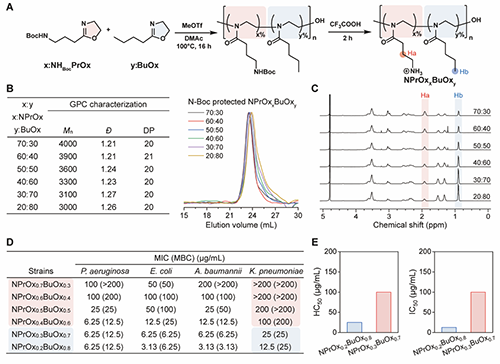
图2:聚(2-噁唑啉)的合成、表征和体外抗菌活性研究。
以优选抗菌聚(2-噁唑啉)NPrOx0.3BuOx0.7为模型,对“酸响应抗菌聚合物前药”策略进行了概念验证。通过2,3-二甲基马来酸酐酰胺化聚(2-噁唑啉)的侧链氨基,可以显著改善抗菌聚合物的生物相容性。聚(2-噁唑啉)前药在小鼠中的最大耐受剂量高达50 mg/kg,且单次或多次给药后对小鼠体重、血清生化指标及肝肾组织均无明显影响。此外DA修饰可降低聚(2-噁唑啉)与血浆蛋白的相互作用,同时血液循环半衰期延长8倍。pH响应性研究显示,前药在酸性条件下30分钟内即可实现84%的DA基团脱保护。通过罗丹明B和5-氨基荧光素两种荧光染料分别标记聚(2-噁唑啉)前药的端基和酸响应性基团,荧光成像显示酸响应性基团发生解离(5-氨基荧光素信号明显衰减),而聚(2-噁唑啉)骨架(罗丹明B标记)在病灶滞留,证实了前药在感染部位的体内转化。进一步的体内分布实验显示,荧光标记聚(2-噁唑啉)在感染大腿的蓄积量达正常组织的4倍,表明其在细菌感染部位富集(图3)。
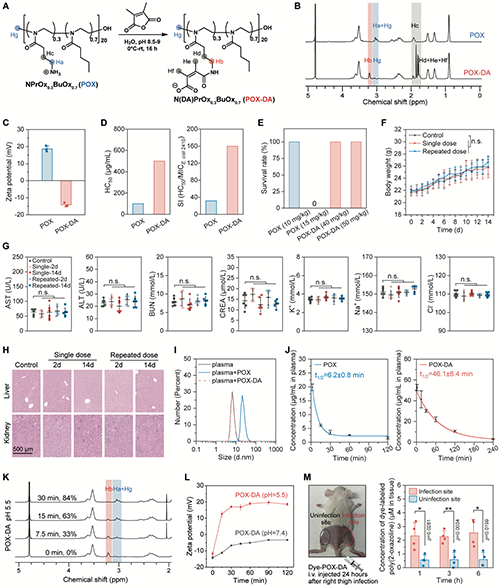
图3:聚(2-噁唑啉)前药的合成、生物相容性和pH响应特性。
随后对聚(2-噁唑啉)前药的体外抗菌性能展开研究。前药显示出优异的pH响应性杀菌动力学特性,酸性条件下可分别在60和120分钟内完全杀灭大肠杆菌和铜绿假单胞菌,而相同时间内在生理环境中无明显杀菌效果。耐药性研究表明,聚(2-噁唑啉)不会诱导细菌产生耐药性和交叉耐药性。此外,聚(2-噁唑啉)前药还可有效根除阴性菌成熟生物被膜,其效果优于传统抗生素多粘菌素E(图4)。
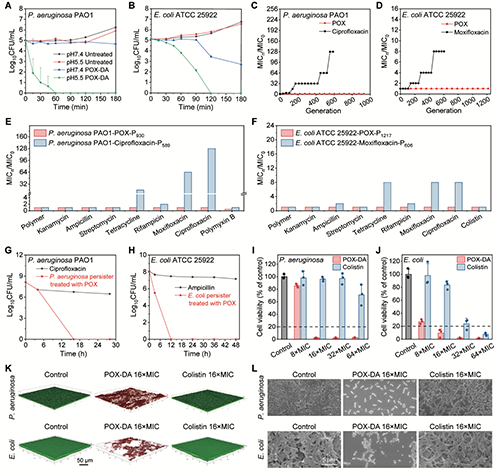
图4:聚(2-噁唑啉)前药的体外抗菌性能。
对聚(2-噁唑啉)的抗菌机制展开研究。荧光示踪显示,聚(2-噁唑啉)首先富集于细菌膜表面,接着造成膜损伤,导致碘化丙啶进入胞内。进一步研究显示聚合物会引起明显的细菌外膜通透性变化和内膜去极化。虽然聚(2-噁唑啉)处理会轻微增加细菌胞内ROS水平,但使用抗氧化剂NAC抑制ROS产生不影响其杀菌效果。SEM和TEM电镜表征也显示聚(2-噁唑啉)处理导致细菌膜结构破坏和胞质内容物泄漏。这些结果共同证实聚(2-噁唑啉)具有膜作用抗菌机制(图5)。
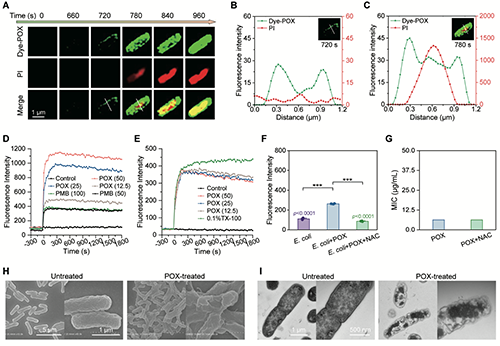
图5:聚(2-噁唑啉)前药的抗菌机理研究。
聚(2-噁唑啉)前药在多种耐药阴性菌感染模型中展现出出色的体内抗菌疗效。在皮下脓肿模型中,聚(2-噁唑啉)前药静脉注射使大肠杆菌和铜绿假单胞菌负荷分别降低0.9和1.9个对数级,疗效与美罗培南相当。中性粒细胞减少大腿感染模型中,聚(2-噁唑啉)前药治疗组存活率提升,感染组织细菌负荷降低2.8个对数级。在肾脏感染模型中,聚(2-噁唑啉)前药使肾脏细菌负荷降低1.9个对数级,并能有效缓解肾脏病理损伤。肺部感染模型中,聚(2-噁唑啉)前药与左氧氟沙星分别使细菌负荷降低1.3和1.7个对数级。在致死性腹膜炎模型中,单次静脉注射聚(2-噁唑啉)前药即可将鲍曼不动杆菌感染小鼠的存活率提升83%,且在主要器官、血液和腹腔液中实现3.2-5.5个对数级的细菌清除,显著缓解各器官病变。这些结果显示聚(2-噁唑啉)前药在局部和全身性感染动物模型中均具有明显治疗效果,与临床一线抗生素相当,为耐药微生物感染治疗提供了新的解决方案(图6)。
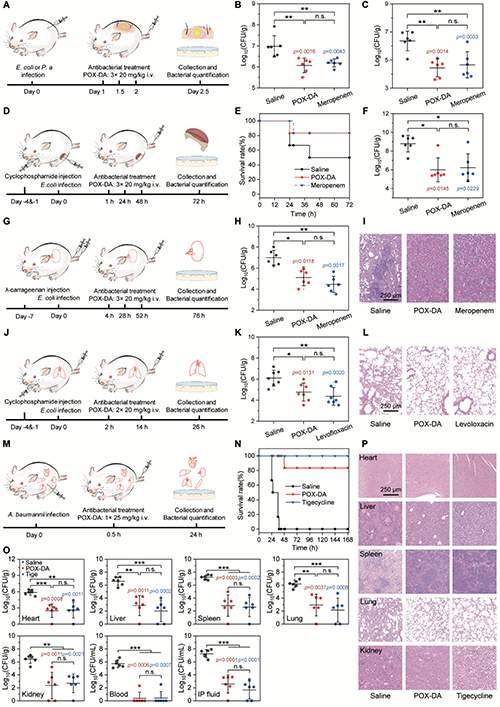
图6:聚(2-噁唑啉)前药的体内抗菌活性研究。
华东理工大学材料科学与工程学院博士生谢佳洋和周敏副研究员是该论文的第一作者,刘润辉教授是论文的通讯作者。该研究得到了国家自然科学基金委、科技部等基金的资助。
论文链接: https://www.science.org/doi/10.1126/scitranslmed.adl4870
- 华东理工刘润辉教授课题组《Nat. Biotechnol.》:基于宿主防御肽模拟物组装体的共递送组合体内协同治疗耐药真菌感染 2026-01-02
- 浙江大学周民/华东理工大学刘润辉 Research: 新型宿主防御肽模拟物通过群体感应干扰和单体杀菌协同模式抑制细菌性肺炎和肝炎 2023-02-04
- 华东理工刘润辉教授课题组 JACS:模拟宿主防御肽的β多肽聚合物用于治疗多药耐药肿瘤 2022-04-15
- 上海交大刘尽尧团队 JACS:智能高分子前药涂层细菌 2023-11-26
- 青岛大学于冰/胡浩团队:活性氧响应型聚合物前药物胶束递送细胞周期调节剂用于化疗增敏 2023-10-09
- 杭州师范大学刘俊秋教授团队《Adv. Sci.》:基于前药骨架的金属有机框架构筑酶驱动纳米马达用于增强肿瘤联合治疗 2023-05-20
