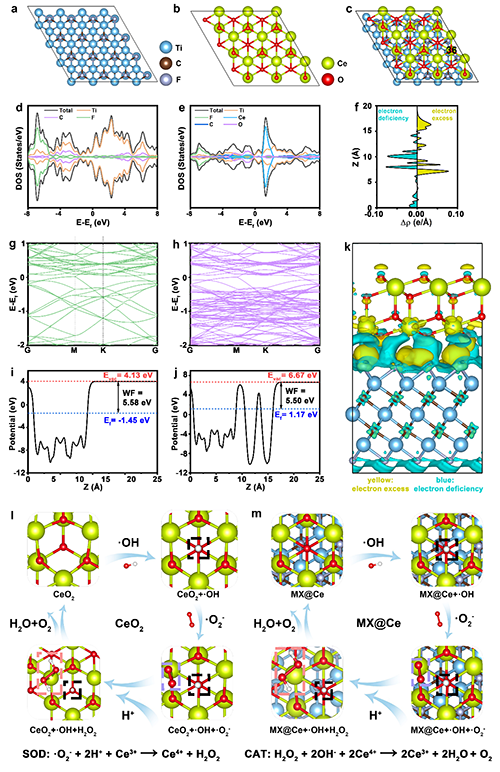
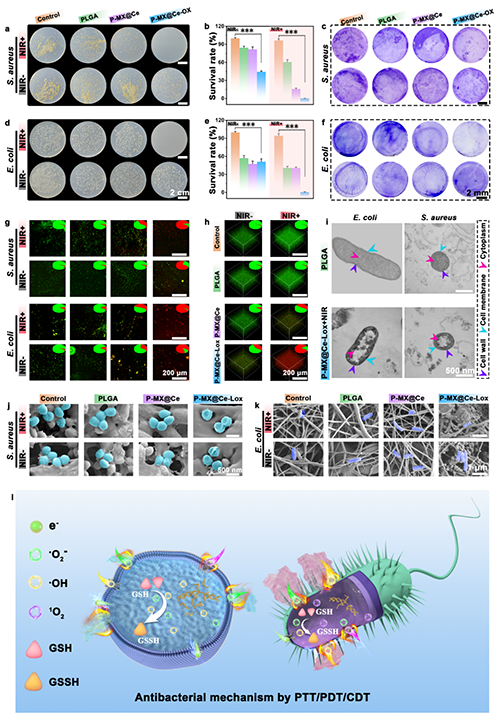
动态治疗利用活性氧物种(ROS)对抗细菌感染并增强固有免疫系统以治疗细菌感染。如果ROS水平过低,则无法有效清除病原体并增强固有免疫。然而,ROS的过度积累可能会影响细胞内谷胱甘肽(GSH)水平,阻碍T细胞成熟和免疫记忆的建立。在此,设计了一种多功能的纳米纤维膜,包含一个聚合物支架、MXene/CeO?生物异质结(MX@Ce bio-HJs)和乳酸氧化酶(Lox)来平衡ROS的产生,用于治疗反复发作的细菌感染。在该系统中,MX@Ce bio-HJs在近红外(NIR)激光下通过光动力治疗(PDT)产生ROS,而Lox对创伤微环境的响应可发挥化学动力学治疗作用,协同产生ROS以快速消灭细菌,增强树突状细胞识别和呈递细菌片段的能力,并增强固有免疫。没有NIR的情况下,MX@Ce bio-HJs表现出类过氧化氢酶和超氧化物歧化酶活性,清除后续ROS积累,促进T细胞成熟以形成获得性免疫记忆,抗击反复发作的细菌感染。这项工作展示了在体抗击细菌感染和反复发作感染的潜力,并为未来抗细菌疗法的发展提供了灵感。
反复的细菌感染常常导致严重的疾病,如败血症、菌血症、肺炎和心内膜炎,极端情况下甚至可能导致死亡。虽然抗生素是治疗此类感染的常规方法,但其过度使用可能导致抗生素耐药菌株的出现,包括多药耐药变种。免疫系统通过多种机制对抗细菌,包括吞噬作用、抗体介导的破坏以及补体介导的细菌膜裂解。成功激活的免疫系统,通过吞噬作用和破坏细菌完整性等方法,可以有效消除细菌并建立免疫记忆,从而治疗反复发作的细菌感染。然而,持续的细菌感染导致免疫失调和逃逸,类似于癌症。因此,必须有效地激活免疫系统来治疗反复发作的细菌感染。
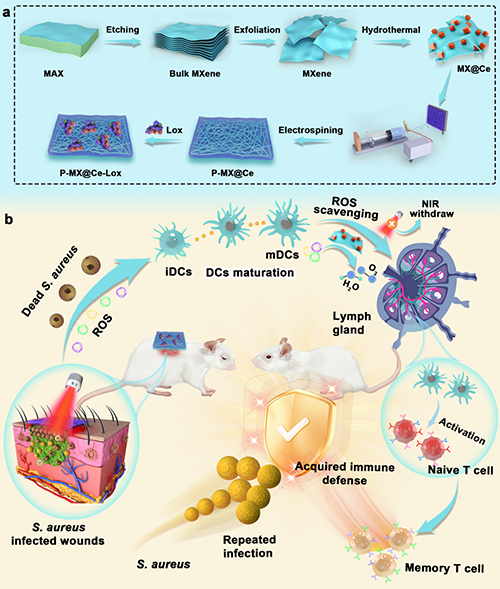
示意图. 光响应生物异质结(bio-HJs)诱导免疫原性以防止感染复发并加速慢性创伤再生。(a)P-MX@Ce-Lox膜的制造过程。(b)使用感染伤口的小鼠进行P-MX@Ce-Lox的体内抗菌和免疫微环境调节研究。
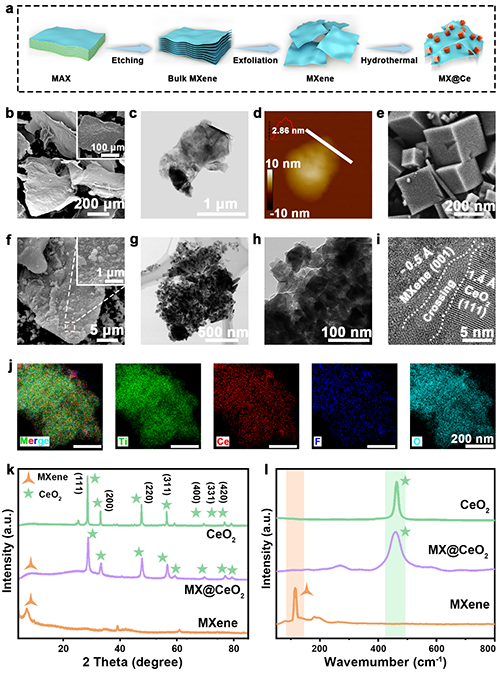
MX@Ce生物异质结表征:(a) MX@Ce生物异质结的形成;(b) SEM图像,(c) TEM图像和(d) AFM图像展示MXene纳米片。(e) CeO?的SEM图像;(f) SEM图像,(g和h) TEM图像,以及(i) HRTEM图像展示MX@Ce。(j) MX@Ce的元素分布图;(k) CeO?、MXene和MX@Ce的XRD图谱;(l) CeO?、MXene和MX@Ce的拉曼光谱。
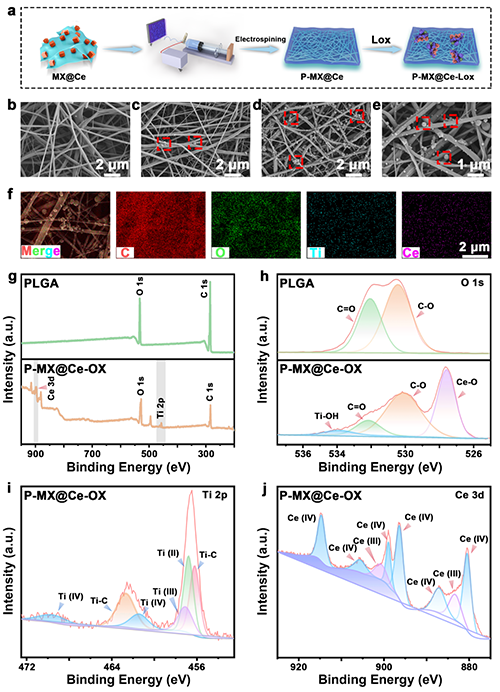


组织病理学分析:(a) 不同治疗后皮肤组织的H&E染色结果。(b) 马松三色染色(绿色箭头表示成熟的胶原纤维),(c) 天狼星红染色及(f) 相应的定量胶原体积分数数据。IL-6的代表性免疫组化图像(绿色箭头表示阳性反应区域)(d)和TNF-α及ICAM-1的免疫荧光图像(e)。(h) 新血管的相关定量分析。(g) IL-6、(h) ICAM-1和(i) TNF-α的定量统计。(j) 伤口愈合、胶原形成、抗菌、炎症和树突状细胞成熟的雷达图。(k) 体内伤口愈合机制。数据以均值±标准差表示(n = 3)。
原文链接:https://doi.org/10.1002/smll.202410522
- 北京化工大学尹梅贞教授/管君副教授团队 AFM: 光响应肽水凝胶通过水开关调控模量用于细胞命运调节 2025-12-13
- 甬江实验室方磊教授团队 AFM:无溶剂介导的热塑性聚氨酯复合材料-具有稳定、可逆的热荧光响应 2025-12-05
- 东北农大张海洋团队 Small:受章鱼启发的刚度可调的智能粘附剂 - 用于空气及水下不平整表面的粘附 2025-09-02
- 四川大学邓怡团队《ACS Nano》:多功能纳米生物异质结复合水凝胶敷料 - 用于伤口细菌生物膜感染的诊疗一体化新策略 2025-03-15
- 川大梁坤能副教授和邓怡研究员团队 Small:糖尿病植入相关感染的新疗法 - 级联放大治疗能力的多功能生物异质结酶工程植入物 2025-01-04
- 川大梁坤能副教授和邓怡研究员团队 Nano Lett.:特洛伊木马生物异质结赋予粘接性水凝胶强大的抗菌和传感性能用于感染皮肤再生 2024-12-11
- 常大王建浩教授、港中大夏江教授 JCR:重组XVII型胶原蛋白微针 →经皮递送抗菌铜-DNA纳米颗粒用于皮肤抗感染修复 2025-01-15
