由创伤、感染和肿瘤切除的发生率不断增加,大型骨缺损的治疗在世界范围内是一个主要的临床问题。为了实现大面积骨缺损的成功愈合,需要在缺损部位植入合适的骨移植物。目前自体骨移植和同种异体移植是治疗临界骨缺损的重要手段,也是金标准。然而,这类骨移植物的局限性,如供体稀缺、病原体转移和免疫排斥等,极大地阻碍了其临床应用。骨组织工程已经成为一种有效的骨修复方法,许多骨组织工程支架被开发,但常用的支架材料(如陶瓷、金属、高分子材料等)生物惰性且支架结构简单,不能实现良好的骨再生能力。因此,近年来基于仿生骨修复的策略备受关注,如从生物学活性或物理结构方面进行仿生。然而,骨组织在重建时需要大量干细胞迁移到缺损处定植和分化并有丰富血管提供养分,同时需要足够的孔隙率,为细胞的黏附和血管化以及新骨生成提供空间、为营养获取和新陈代谢提供交换通道。仅实现物理结构或生物活性某一方面的仿生都难以获得最佳的骨修复性能。
针对以上挑战,华东理工刘润辉教授与合作者合作研发了一种兼具物理结构与生物活性功能的双仿生 3D 打印的大段骨修复支架。这种模拟结构的支架具有各向同性的单细胞结构,适用于承受不同负荷要求的缺损情况,并且允许血管和骨向内生长。同时,为了实现仿生生物功能,采用刘润辉课题组前期发现的模拟细胞外基质肽的β-氨基酸聚合物 DM50CO50 来促进细胞黏附(Nat. Commun. 2021, 12, 562.)。这种没有特定氨基酸序列和结构的聚合物,能够促进干细胞黏附,其效果可与金标准RGD相媲美,并且克服了与肽相关的蛋白水解问题。并通过课题组前期发现的DbaYKY 的三肽来引发聚合反应,从而能够快速且高效地将聚合物功能化到支架表面(Nat. Commun. 2021, 12, 6331)。此外,通过将去铁胺(DFO)与亚氨基二乙酸(IDA)偶联对其进行修饰,赋予其寻钙能力。所得的合成分子(SF-DFO)可螯合到硅钙石支架及其他含钙支架上,作为一种涂层材料将 DFO 的血管生成特性嫁接到支架上。管形成实验表明,SF-DFO 与 DFO 一样能促进血管生成,因为二者均能够促使类血管管腔形成。这种双仿生的3D 打印支架能够有效促进大段骨修复,为仿生骨修复材料设计提供新的思路。
2024年12月26日,该研究成果以“3D-Printed Dual-Bionic Scaffolds to Promote Osteoconductivity and Angiogenesis for Large Segment Bone Restoration”为题发表在Advanced Functional Materials上(Adv. Funct. Mater. 2024, 2422691 DOI: 10.1002/adfm.202422691)。
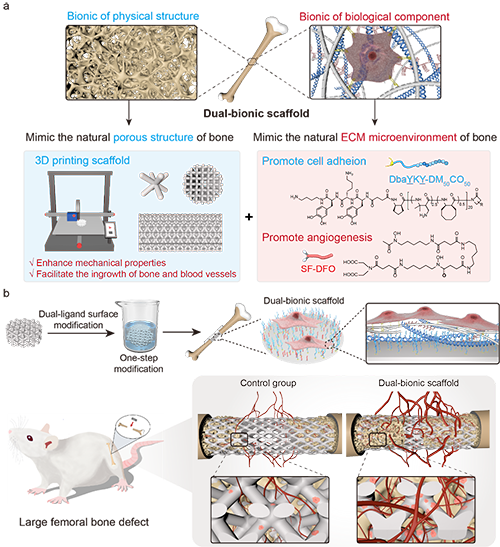
图1. 双仿生 3D 打印的白硅钙石支架
首先,为实现对物理结构的仿生,作者选择了一种成分与骨基质相似的白硅钙石生物陶瓷作为基材,通过3D打印技术制备具有各向同性单细胞结构且孔隙率约为 59%±5% 的支架。这种孔隙率便于血管和骨向内生长,为骨再生提供了必要的支撑(图 1a)。该支架的抗压能力与传统的交叉结构支架相当,而在抗弯、抗剪以及抗扭方面则更胜一筹,这使得这一支架能够通过为新骨形成提供适当的应力刺激,同时有效防止过度的应力遮挡,适用于承受不同负荷要求的缺损情况。
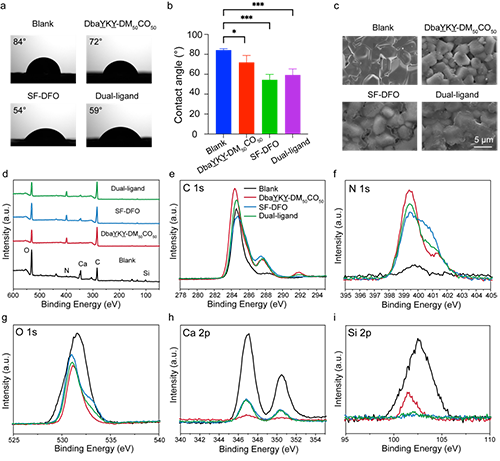
图2. 支架材料的表面表征
将促细胞黏附多肽和DFO双重修饰的支架材料接种绿色荧光蛋白(GFP)- 荧光素酶(Luc)标记的骨髓间充质干细胞(BMSCs)的支架皮下植入裸鼠体内。在植入后的第 0、3 和 5 天进行生物发光成像。结果显示,该支架不仅能够在体外促进细胞增殖,而且还能提高体内的细胞存活率。另外,与在普通培养基中培养细胞且无额外干预的阴性对照组相比,DFO 和 SF-DFO 均显著上调了 HO-1 和 VEGF 的表达。
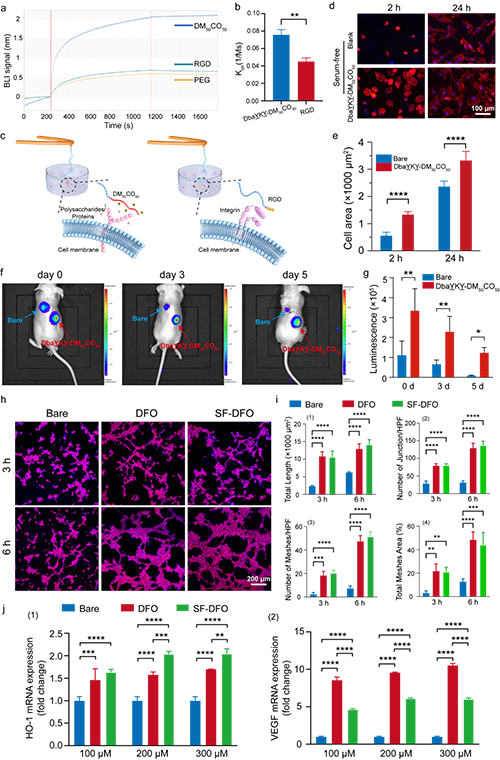
图3. 支架材料促细胞黏附和促血管生成效果
这种 3D 打印的硅钙石支架的压缩模量和刚度分别高达 6 GPa和 5000 N/mm,这大大超过了骨小梁支架 2 GPa的最低要求。作者设计的支架平均孔径为 450 μm,孔隙率为 59%,在机械完整性和生物学性能之间实现了最佳平衡,超过了骨组织工程支架 50 至 900 μm的平均范围。这种设计确保了有充足的空间来供应氧气和营养物质,这对于促进支架孔隙内的血管生成和成骨作用至关重要。
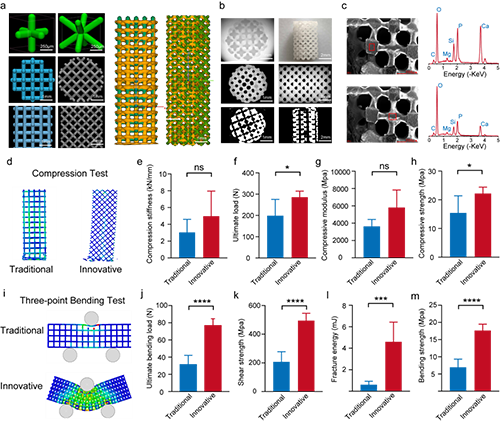
图4. 支架材料的力学性能
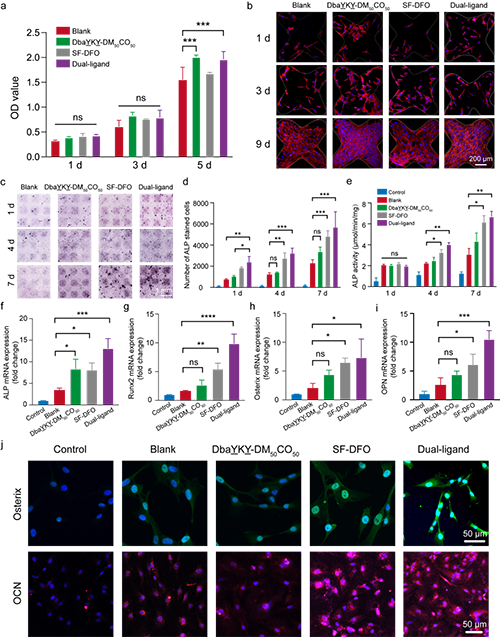
图5. 支架材料的成骨分化
作者设计的这种具有双重仿生设计理念的骨修复支架不仅在体外展示了良好的干细胞粘附和血管形成效果,大鼠的大断骨缺损模型也验证了该支架优异的成骨和成血管能力,显著加速了临界尺寸骨缺损的修复。这一结果证实了结构和功能的双重模拟,将更加有效的模拟天然骨组织并利于相互功能的发挥,也进一步为临床前应用奠定了坚实的基础。
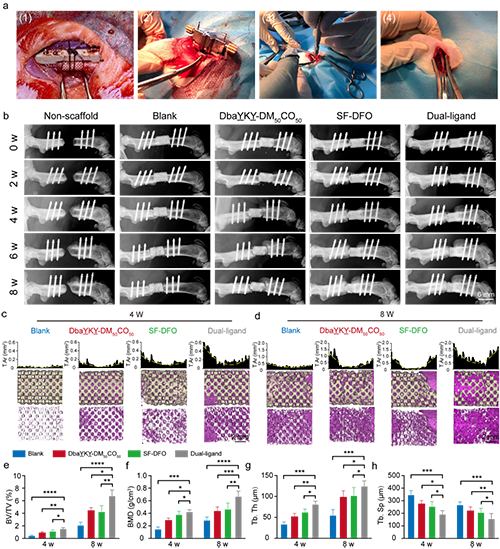
图6. 大断骨缺损体内修复
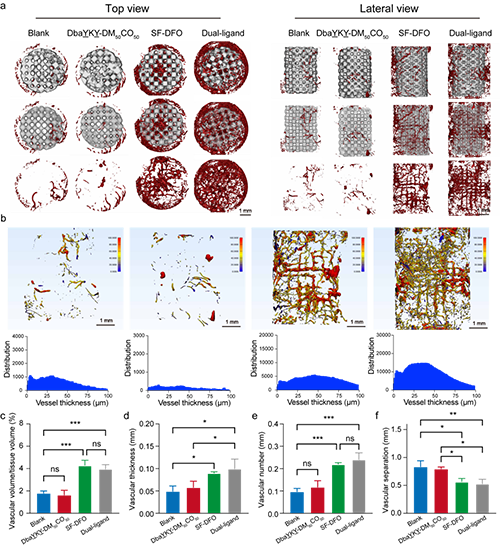
图7.体内血管形成效果
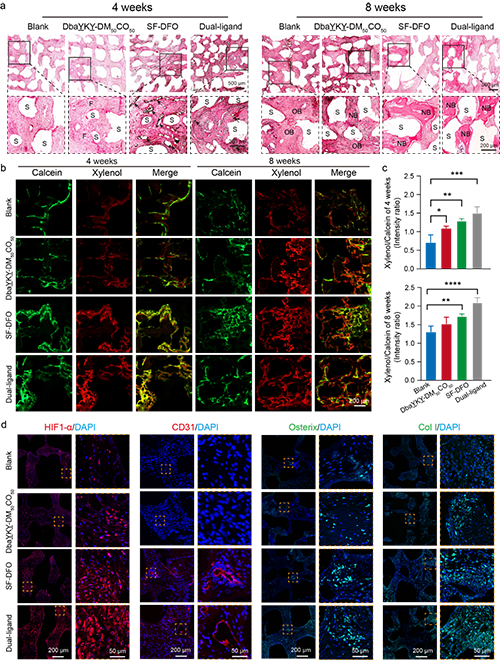
图8. 体内骨修复效果
上海交通大学陈博博士、华东理工大学特聘副研究员陈琦为该论文的第一作者,华东理工大学刘润辉教授为通讯作者。该研究得到了国家自然科学基金委、科技部等基金的资助。
论文链接:https://doi.org/10.1002/adfm.202422691








