结直肠癌(CRC)部位存在高丰度的具核梭杆菌(Fn),促使肿瘤部位炎性因子升高,促进肿瘤新血管生成;同时,巨噬细胞向M2型极化,下调体内的CD4+ T细胞和CD8+ T细胞,形成免疫抑制微环境。
基因治疗是将正常或治疗性基因递送到靶细胞中,复制表达,达到治疗疾病的目的,在疾病治疗领域已展现出巨大的应用前景。鉴于Fn感染对CRC治疗效果的不利影响,迫切需要开发具有高抗菌活性和安全性的多功能基因递送体系来消除Fn的不良影响,提高对Fn感染的CRC的治疗效果。
针对上述挑战,天津工业大学高辉教授课题组研发了一种治疗Fn感染CRC的新策略,制备了一种具有肿瘤细胞主动靶向性的基因递送体系(AFGTs-PEG),递送抗菌剂月桂酸(LA)和抗血管生成基因(sFlt-1),通过抗Fn实现了对Fn感染CRC的增强基因治疗。这为高效安全的抗肿瘤基因递送载体的构建及致病菌相关肿瘤的治疗问题提供了具有临床应用前景的研究思路。
2024年12月20日,该研究成果以“Remodeling the Inflammatory and Immunosuppressive Tumor Microenvironment for Enhancing Antiangiogenic Gene Therapy of Colorectal Cancer”为题发表在Advanced Healthcare Materials上(DOI: 10.1002/adhm.202402887)。
高辉教授课题组前期研究发现月桂酸(LA)具有优异的抗Fn活性。作者将LA和靶向分子4-羧基苯硼酸(PBA)修饰到低分子量的聚乙烯亚胺(OEI)中并与LA自组装得到LA@OLP(AFs)。AFs复合sFlt-1并与DSPE-mPEG共组装得到LA@OLP/sFlt-1/DSPE-mPEG(AFGTs-PEG)。体内实验表明AFGTs-PEG可以有效清除Fn,降低体内炎性因子,抑制M1巨噬细胞向M2巨噬细胞的极化,上调CRC部位CD4+ T细胞和CD8+ T细胞,改善肿瘤炎症和免疫抑制微环境,解除Fn对抗血管生成基因治疗的不良影响,在活体水平协同发挥显著的抗血管生成作用,实现对Fn感染CRC的增强的基因治疗效果(图1a和b)。细胞毒性、溶血和H&E染色实验表明AFGTs-PEG具有良好的生物相容性和安全性。

图1. AFGTs-PEG的制备及治疗Fn感染CRC示意图。
通过平板涂布法和菌落计数(图2a和b)表明AFGTs-PEG具有与LA相似的抗Fn性能。扫描电镜(图2c)表明AFGTs-PEG处理后,Fn的细胞膜被破坏,形态结构发生明显变化。AO/EB染色(图2d)再次表明AFGTs-PEG造成了Fn的大量死亡。结晶紫染色和3D成像(图2e和f)显示AFGTs-PEG对Fn形成的生物被膜具有高效的分散清除能力。
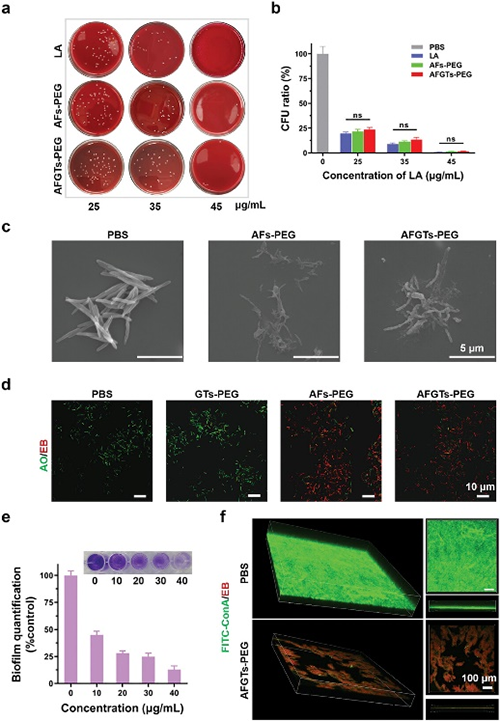
图2. 体外抗菌和抗生物膜性能。
基于AFGTs-PEG优异的体外抗菌性能,作者进一步评价其体外抑制血管生成效果。凝胶电泳实验(图3a)表明AFGTs-PEG在氮磷比为10时可以有效复合sFlt-1,从而避免sFlt-1在运输过程中的泄露和过早释放问题。质子缓冲能力实验(图3b)表明AFs具有与基因递送“黄金标准”PEI25K相似的内含体逃逸能力。细胞转染实验(图3c-e)表明LA:OLP(质量比)为3:1时且氮磷比为10时,转染效率最高,因此选用此比例进行后续实验。体外抑制血管形成实验(图3f和g)表明即使在Fn感染条件下,AFGTs-PEG也能显著地降低血管的形成。

图3. 体外转染性能。
药物体内分布实验(图4a)表明,AFGTs-PEG可以显著和长时间地富集在肿瘤部位。通过统计小鼠的体重和肿瘤体积(图4c-e),表明AFGTs-PEG治疗后,小鼠体重没有发生明显的降低,并且肿瘤的体积最小,表明其优异的抗肿瘤性能。通过肿瘤组织的H&E染色和小鼠生存周期(图4f和g)表明AFGTs-PEG生物相容性和安全性高,并不会对身体造成明显的损伤。

图4. 体内生物分布和抗肿瘤性能。
基于AFGTs-PEG优异的抗肿瘤性能,作者进一步探究AFGTs-PEG的抗肿瘤机理。首先,通过原位荧光杂交技术标记肿瘤部位的Fn,结果显示(图5a和b)经AFGTs-PEG治疗后,肿瘤部位的Fn丰度显著降低。酶联免疫吸附实验(图5c-e)也表明体内的细胞因子(IL-1β、TNF-α和IL-6)水平降低至正常水平。肿瘤部位的血管密度(图5f和g)和sFlt-1表达(图5h和i)表明,经AFGTs-PEG治疗后,sFlt-1大量表达,肿瘤部位的血管密度显著降低。

图5. 重塑体内肿瘤炎症微环境。
接下来,研究了AFGTs-PEG对免疫抑制微环境(图6a-d)的改善。结果表明AFGTs-PEG治疗后,M1巨噬细胞向M2巨噬细胞的极化被抑制。同时,CD4+ T细胞和CD8+ T细胞的水平显著升高。

图6. 重塑体内免疫抑制微环境。
总之,AFGTs-PEG通过递送抗菌剂LA和抗血管生成基因sFlt-1,协同免疫相关细胞和基因治疗实现了对Fn感染CRC的安全高效治疗。值得注意的是,与常见的治疗策略不同,抗血管生成基因治疗是一种新颖的、安全高效的癌症治疗策略。与化疗药物不同,通过合理的递送体系设计可以对不同肿瘤实现有效的抗血管生成基因治疗,进一步体现了本研究成果在致病菌感染肿瘤治疗中的巨大应用前景。
天津工业大学硕士毕业生牛家振和教师苏美慧为该论文的第一作者,高辉教授为通讯作者。
论文链接:https://doi.org/10.1002/adhm.202402887






