自COVID-19出现以来,基因治疗和mRNA疫苗取得了快速进展,使得核酸药物在医学领域的地位日益突出。然而,相对较大且带负电荷的核酸分子容易受到细胞膜阴离子脂质层的静电排斥,导致跨膜运输困难。进入体内的核酸分子将面临免疫系统的清除、血液中核酸酶的降解以及细胞内溶酶体核酸酶的降解。在缺乏合适的载体的情况下,核酸药物的体内效率仍然很低。目前由脂质体、阳离子聚合物、和无机纳米粒子组成的核酸纳米递送载体尚不完善,包括细胞转染效率低、对细胞的细胞毒性以及在生理条件下不稳定等。因此,载体如何实现将核酸药物选择性的递送至靶细胞的细胞质中发挥作用是目前亟需解决的问题。
近期,暨南大学戴箭课题组设计构建了一种可以响应肿瘤的微酸性环境通过膜融合的方式将核酸直接递送至肿瘤细胞质的溶瘤病毒样纳米颗粒OV@FN。OV@FN由负载核酸的纳米核心NA-Zn@G和表达溶瘤病毒融合膜糖蛋白(mVSV-G)的杂合膜囊泡FN构成,其中FN可响应肿瘤微酸性环境通过膜融合的方式将负载核酸的纳米内核递送至肿瘤细胞胞质中,随后NA-Zn@G响应肿瘤细胞细胞质中高浓度的谷光甘肽以在肿瘤细胞质中精准释放核酸。研究结果表明:与正常细胞相比,OV@FN可以有效且精准地将核酸药物递送至肿瘤细胞的细胞质中。更重要的是,FN可有效诱导肿瘤细胞之间相互融合形成合胞体以促进细胞内核酸药物的扩散,大大增加了基因治疗的效果。因此,OV@FN为基因递送载体和肿瘤免疫治疗平台提供了一种新的策略。相关的工作以“Oncolytic Virus-Like Nanoparticles for Tumor-Specific Gene Delivery”为题发表在Advanced Functional Materials。
【文章要点】

图1 溶瘤病毒样纳米颗粒OV@FN的制备和性能示意图。
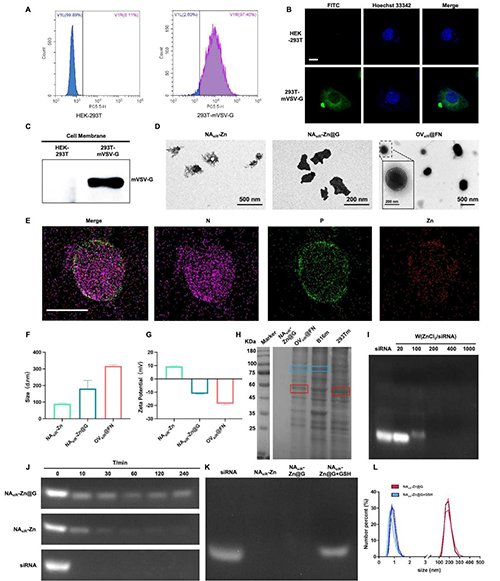
图2 OV@FN的材料表征

图3 OV@FN的体外性能表征。

图4 杂合膜FN上mVSV-G促进肿瘤细胞之间的融合。

图5 杂合膜FN对荷瘤小鼠的治疗效果。

图6 OV@FN的体内基因递送效率。
综上所述,本研究提出了用于核酸递送的溶瘤病毒样纳米颗粒OV@FN。OV@FN将肿瘤特异性抗原与病毒融合蛋白相结合,显示出增强的肿瘤靶向性和激活强肿瘤特异性免疫反应的能力。OV@FN在肿瘤弱酸环境中表现出高效的核酸递送能力,为RNAi治疗提供了安全有效的纳米颗粒。此外,OV@FN可以诱导肿瘤细胞相互融合并在肿瘤部位形成合胞体。合胞体表面的mVSV-G和合胞体裂解后释放的肿瘤相关抗原可以与核酸药物配合,诱导强烈的肿瘤特异性免疫反应。OV@FN通过模仿病毒结构揭示了可扩展的核酸药物递送平台,也为扩展基于病毒的肿瘤免疫治疗提供了新的仿生策略和理念。
论文信息:
Oncolytic Virus-Like Nanoparticles for Tumor-Specific Gene Delivery
Yuchao Li#, Haiyuan Yang#, Xiaoqing Zong, Xiaodi Li, Pengfei Yuan, Caiqi Yang, Xinjie Chen, Xiaodie Yan, Yaoqi Wen, Tianci Zhu, Wei Xue, Jian Dai*.
Advanced Functional Materials
DOI: 10.1002/adfm.202314898
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202314898
- 上海市第一人民医院马小军/东华大学何创龙 Bioact. Mater.:TME响应复合水凝胶靶向抑制MYC驱动型骨肉瘤生长与转移 2025-01-17
- 南方医科大学沈折玉教授、新加坡国立大学陈小元教授《Adv. Mater.》:一种用于MRI引导肿瘤铁死亡治疗的与逻辑门 2023-09-28
- 北化徐福建团队/青大胡浩团队《J. Control. Release》综述:基于多糖的肿瘤微环境响应药物递送系统用于肿瘤治疗 2023-08-25
- 昆士兰大学乔瑞瑞教授团队 AFM:液态金属纳米颗粒赋能高分辨水凝胶3D打印 2025-12-01
- 北化许海军教授团队 CEJ: 低成本原位光催化技术突破摩擦纳米发电机高性能电极瓶颈 →在疏水性聚合物表面原位生长银纳米颗粒电极 2025-08-07
- 华南理工大学王林格教授团队 Small:以聚合诱导自组装方法制备与调控具有刚性直链成核链段的球状液晶纳米颗粒 2025-07-13
- 天工大高辉教授团队 AHM:提升结直肠癌的抗血管生成基因疗法重塑炎症和免疫抑制性肿瘤微环境 2024-12-26
