华侨大学陈爱政和南方医大王颖 Compos. Part B:基于dECM工程化微组织协同增强分化和抗炎作用促进骨关节炎的软骨再生
骨关节炎(OA)是一种以关节软骨破坏和关节囊炎症为特征的慢性疾病,是导致全球残疾的主要原因。伴有软骨退化、异常骨质增生或骨质增生、滑膜,包括炎症和软骨下骨变化的病理临床症状。软骨对关节功能至关重要,尤其是承重和润滑功能,软骨的退化是导致残疾的重要原因。目前,临床上治疗 OA 的主要软骨再生系统一般分为非药物、药物和手术治疗干预。然而,这些方法的适用性还面临着一些挑战。骨髓间充质干细胞(BMSCs)具有自我更新、多向分化和免疫调节的巨大潜力,因此特别适合解决与OA相关的复杂问题。BMSCs是诱导软骨再生的一条极具前景的途径。然而,要确保BMSCs能可靠地分化为软骨细胞,许多参数都需要细致的优化,如包括细胞数量、保留、存活以及与宿主组织的无缝整合。考虑到这些方面,团队设计了一种对BMSCs高保活性的工程化微组织定向调控BMSCs的软骨细胞向分化,实现细胞的高效、可重复的控制,提高了空间和时间效率。
在本研究中,华侨大学陈爱政教授课题组和南方医科大学第十附属医院王颖副研究员课题组通过微流控技术构建了一种基于软骨脱细胞基质(dECM)和聚乳酸羟基乙酸共聚物(PLGA),并成功包封了具有淫羊藿苷(ICA)的工程微载体。这种微载体与BMSCs共培养,被开发为一种面向OA软骨再生的可注射工程化微组织。从机制上看,dECM通过可诱导BMSCs分化为软骨细胞表型,从而有效修复软骨缺损。在抗炎方面,dECM增强BMSCs对活性抗炎物质的分泌,负载的 ICA可持续释放至微环境中,进一步抑制局部炎症反应,减少软骨组织的破坏,为稳定关节微环境和促进软骨再生提供了重要保障。这种协同作用使工程化微组织在保护和修复软骨方面表现出显著优势(图1)。

图1 研究示意图
团队首先对dECM材料和天然软骨进行了详细比较,重点分析了其组织成分的比例。结果显示,dECM中高保留率的软骨ECM成分。此外,检测发现dECM的DNA含量低于50 ng/mL,表明其免疫原性已被有效去除,使其能够安全应用于后续的生物实验。接着,团队系统评估了ICA@dECM-PLGA多孔微球的理化特性。通过扫描电子显微镜(SEM)观察发现,这种微球具有高度多孔的结构,其相互连通的高孔隙率显著提高了细胞的粘附性和渗透能力(图2)。此外,微球中包埋的ICA表现出卓越的长效缓释性能,不仅延长了药物的作用时间,还为软骨修复提供了持续的抗炎微环境支持,为软骨修复提供了可靠的基础。

图2. ICA@dECM-PLGA PMs的生物和理化表征
如图3所示,团队系统地评价了基于ICA@dECM-PLGA工程化微组织的再生机制及其在软骨修复中的潜力。首先,通过H&E染色和番红染色,团队观察并分析了微组织内细胞的活性状态。结果显示,细胞在微组织中保持良好的活性,能够牢固接合,其形态呈现舒展状态,并形成了相互连接的网络结构。这种细胞状态不仅表明微组织提供了一个适宜细胞黏附与增殖的环境,也为后续的软骨组织再生奠定了良好基础。进一步,通过Col-2荧光染色,团队检测到了大量软骨基质的沉积,明确显示了该系统在软骨修复中的潜力。Col-2是软骨组织的重要标志物,其大量生成表明工程化微组织能够有效促进软骨组织的生成与重建。同时,这些结果也验证了ICA@dECM-PLGA工程化微组织在改善软骨微环境方面的优势。最后,通过PCR分析显示该系统显著促进了BMSCs向软骨分化,同时表现出较强的抗凋亡活性。这一发现进一步表明,ICA@dECM-PLGA工程化微组织在促进细胞分化、维持细胞活力以及提供理想软骨修复条件方面具有重要作用。这些研究为后期工程化微组织在软骨组织修复中的植入应用提供了理论依据。

图3. 工程化微组织活性状态及促软骨分化的表征
炎症因子的过度释放是阻碍OA软骨再生的主要挑战之一。这些炎症因子通过破坏软骨细胞在合成与分解之间的动态平衡,严重削弱软骨组织的修复能力,从而加剧了软骨的退化进程。因此,为OA软骨再生提供稳定的抗炎微环境是软骨修复研究的关键目标。如图 4所示,为了评估工程化微组织在抗炎环境中的作用,团队构建了LPS诱导的炎症模型,对工程化微组织的抗炎性能进行了分析。工程化微组织对炎症因子(如IL-1β、IL-6和TNF-α)水平的显著降低,表明其在缓解炎症反应方面具有优越性能。此外,团队进一步收集了工程化微组织的培养上清液,并通过将其冻干后与新鲜培养基混合,与软骨细胞共培养,以测试工程化微组织对对软骨细胞的调控。结果显示,结果显示工程化微组织可有效清除软骨的活性氧和活性氮在抗炎修复展现出优异性能。综合来看,该工程化微组织在改善炎症微环境、清除有害代谢物具有一定潜力。

图4. 工程化微组织的抗炎特性
通过代谢组学分析,识别了差异代谢物小分子,并构建了它们的相互作用网络图和KEGG富集途径图。结果显示,在工程化微组织作用下,BMSCs显著上调了与细胞核蛋白合成、线粒体活性及能量代谢相关的关键通路。这种代谢激活不仅增强了细胞的迁移和增殖能力,还优化了其对外界刺激的响应能力,为后续体内注射时维持细胞高活性提供了坚实基础。此外,高活性的BMSCs在免疫调控方面展现出巨大潜力。研究表明,这些细胞能够通过分泌抗炎因子和调节免疫细胞活性,有效改善炎症微环境,进一步巩固工程化微组织的抗炎性能,稳定微环境的稳态,为后续软骨组织的再生提供理想条件。总之,代谢组学分析从分子水平全面揭示了工程化微组织对BMSCs功能的深远影响,进一步从多角度侧面验证了其在促进软骨再生和抗炎调控中的潜力(图5)。这一结果不仅为相关机制研究提了重要理论支持,也为未来开发针对OA的精准治疗策略奠定了基础。
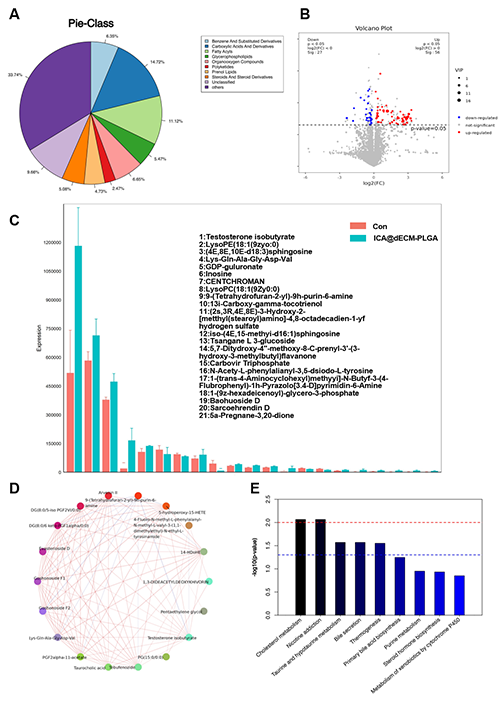
图5. 代谢组学分析
如图6所示,团队通过解剖评估直观展示了注射工程化微组织后各组的软骨修复情况。在OA组中,明显观察到周围滑膜红肿、粘连,关节腔结构紊乱,软骨表面存在多处溃疡,且软骨组织出现严重磨损甚至剥蚀,表现出典型的OA病理特征。相比之下,经过工程化微组织治疗的组别显示出显著的修复效果,软骨表面仅有少量轻微磨损,滑膜边界清晰可见,关节腔结构接近正常,表明工程化微组织在保护和修复软骨组织方面具有显著优势。进一步,为了量化各组炎症状态的差异,团队采用近红外热成像技术监测了关节部位的局部温度变化。结果显示,OA组的局部温度显著升高,反映出明显的炎症反应,而工程化微组织治疗组的局部温度接近正常水平,提示其有效降低了关节部位的炎症活性。此外,团队结合血常规分析和血清上清液检测评估了炎症因子的表达水平,包括IL-1β、IL-6和TNF-α等重要炎症标志物。结果表明,工程化微组织治疗组显著降低了这些炎症因子的水平,进一步证实了其在调节炎症微环境方面的作用。这些研究结果表明,工程化微组织能够有效缓解OA的炎症反应,并在保护滑膜和稳定关节微环境方面发挥了重要作用。

图6. 工程化微组织治疗后大鼠炎症因子和血细胞的体内评价
团队进一步评估了OA治疗后组织形态学特征。如图7所示,软骨表面切片的H&E染色结果显示,在OA组中,软骨细胞明显脱落,软骨组织出现侵蚀,间质内纵向和横向断裂明显,呈现典型的OA病理特征。相比之下,接受工程化微组织治疗的组别显示组织边界平整光滑,仅有少量软骨碎屑,且未观察到明显的组织损伤,表明治疗显著改善了软骨结构完整性。番红/固绿染色进一步验证了显示在工程化微组织治疗组中,仅观察到少量软骨细胞脱落,软骨表面光滑,细胞间连接紧密,表明软骨组织的结构得到了显著改善。此外,团队采用Micro-CT技术评估了软骨下骨的钙沉积和骨密度变化。结果显示,在OA模型组中,大鼠表现出明显的OA特征,骨质侵蚀软骨下骨排列紊乱不均匀,关节内侧缘可见骨赘形成。与OA组相比,工程化微组织治疗组的骨形成和软骨下骨密度显著增加,提示微组织有效促进了骨组织的修复和重建。因此,团队设计的工程化微组织在软骨生成和抗炎调控方面表现出显著效果,可有效改善OA病理状态,显示了其在OA治疗中的潜在应用价值。

图7. 工程化微组织治疗后软骨和骨组织的形态学评价
以上相关成果以“Engineered dECM-based microsystem promotes cartilage regeneration in osteoarthritis by synergistically enhancing chondrogenesis of BMSCs and anti-inflammatory effect”为题,近期在线发表于《Composites Part B: Engineering》。论文通讯作者为华侨大学陈爱政教授和南方医科大学第十附属医院王颖副研究员,论文第一作者为南方医科大学第十附属医院和华侨大学联合培养学生2023届硕士毕业生陈影和华侨大学2021级博士生陈林飞。
研究工作得到国家自然科学基金(32071323、32271410、32201110)、广东省自然科学基金(2022A1515011442)以及福建省生物材料科技创新团队项目的资助。
论文链接:https://doi.org/10.1016/j.compositesb.2024.111974
通讯作者简介:
陈爱政:博士、教授、博士生导师。
华侨大学化工学院院长、生物材料与组织工程研究所所长,享受国务院政府特殊津贴专家,入选国家百千万人才工程、被授予“有突出贡献中青年专家”荣誉称号,入选福建省A类高层次人才,获福建省优秀教师等荣誉。目前担任中国生物材料学会理事、中国生物医学工程学会理事、中国生物材料学会生物复合材料分会秘书长、生物医用材料闽台科技合作基地负责人、福建省生物材料科技创新团队带头人、福建省生物材料化工博士生导师团队带头人、福建省党外知识分子联谊会副会长。主持国家重点研发计划政府间国际科技创新合作重点专项、国家自然科学基金海峡联合重点项目等国家级课题10项。主要从事超临界流体技术及生物材料与组织工程领域的研究,以通讯作者在AM、AFM、Adv Sci、Small、JCR、AHM、BAM、Biomaterials等期刊发表SCI收录论文150余篇,获授权国家发明专利10余项。课题组网页:https://www.x-mol.com/groups/hqubiomat
王颖:博士、副研究员、硕士生导师
王颖,副研究员,硕士生导师,东莞市特色人才第三类别,东莞智能生物材料与再生医学重点实验室副主任,南方医科大学高层次引进人才,多伦多大学博士后,自2021年12月起至今担任《中国材料科学进展》编委。主要从事于病理组织模型构建和器官芯片的研究工作,包括水凝胶、高分子聚合物等生物材料、血管化组织工程、药物筛选、微流控技术、生物3D打印等相关研究。主持国家自然科学基金青年基金1项、广东省自然科学基金面上项目1项、广东区域联合基金地区培育项目1项、东莞市社会发展科技重点项目1项。研究成果以通讯作者、第一作者在包括Adv Sci、Biomaterials、BAM、Composites Part B: Engineering、Biofabrication等国际一流学术期刊累计发表SCI论文20余篇。







