光动力治疗凭借其低毒性、低耐药性和高时空选择性等优点在肿瘤治疗方面取得了显著的效果。但其疗效仍受肿瘤内部固有的乏氧微环境属性、作用范围小和光敏剂产ROS能力不足等因素制约,严重阻碍其在临床实践中的广泛应用。近些年,具有生物活性的气体(如H2、NO、CO)已被开发用于抗肿瘤治疗,且由于CO具有较小的分子尺寸、高跨膜扩散率等优点,使其成为肿瘤治疗的有利候选者。然而,单独的传统CO气体治疗效果并不明显,且它在时空上的不可控性带来严重的副作用。因此如何实现CO气体在肿瘤部位精准的按需释放以提高CO气体对肿瘤的治疗效果是亟待解决的关键科学问题。
基于此,华南理工大学唐本忠院士团队冯光雪教授联合南开大学丁丹教授合作构建了一种高效的多功能纳米平台(TPyNO2?FeCO NPs),该纳米平台主要通过利用两亲性的聚合物(DSPE-PEG2000)将高效的具有双模态活性氧(ROS)产生能力的有机光敏剂和一氧化碳(CO)气体供体十二羰基铁(Fe3(CO)12)共封装而得到。值得一提的是,在前期略构筑高效的I/II型有机光敏剂的研究工作基础上(Biomaterials, 2022, 280, 121255; Mater. Chem. Front., 2023, 7, 96–105; ACS Nano, 2022, 16, 9130?9141; ACS Nano, 2023, 17, 16993?17003; Adv. Mater. 2023, 35, 2208692),本工作通过协同光诱导电子转移机制(PET)策略,在阳离子化光敏剂(TPyOH)骨架中进一步引入4-硝基苄基,实现光敏剂 (TPyNO2)的分子内α-PET过程。这不仅抑制了光敏剂TPyNO2的辐射衰变,促使激发态能量重新定向到系间窜越以形成更多的三重态,而且有效促进了分子内的电子分离和转移过程。使得TPyNO2在受光激发后,不仅有效提升单线态氧(1O2)生成,而且显著增强其自由基型ROS生成效率。此外,在光照射下,TPyNO2?FeCO NPs通过I型和II型双模态ROS协同介导实现CO气体的高效受控释放,克服了传统CO释放系统的局限性。最重要的是,TPyNO2?FeCO NPs在肿瘤细胞内表现出自加速的ROS?CO?ROS循环,有效提升细胞内的ROS水平。体外和体内实验验证了PDT和CO气体联合治疗的良好抗肿瘤疗效和生物相容性。该研究为高性能有机光敏剂的开发提供了新的见解,为光动力治疗和CO气体的协同可控治疗提供新思路。
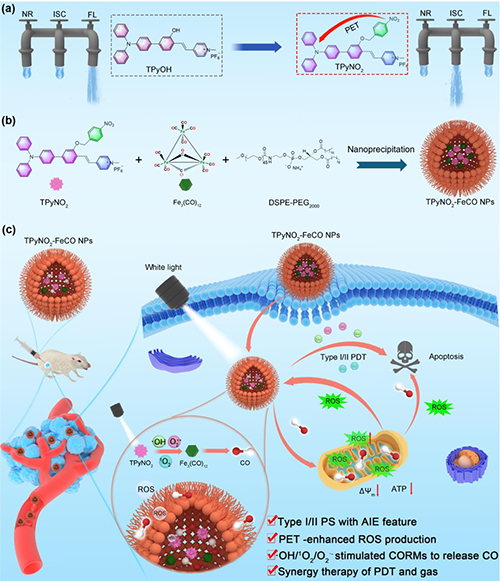
方案1. 用于协同PDT和CO气体治疗的TPyNO2?FeCO NPs纳米平台原理图。(a)分子内光诱导电子转移(PET)增强TPyNO2的ROS生成示意图。NR:非辐射衰变;ISC:系统间交叉;FL:荧光。(b) TPyNO2?FeCO NPs的合成示意图。(c)用于协同PDT和CO气体治疗的TPyNO2?FeCO NPs纳米平台示意图。
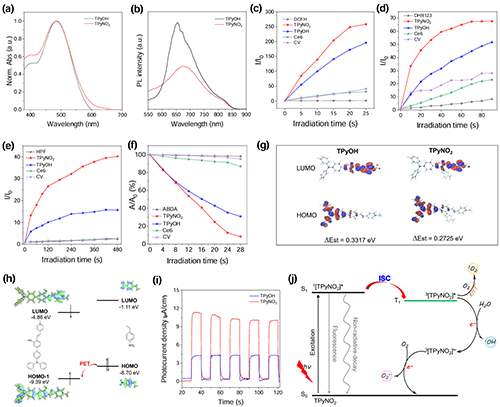
图1. (a) TPyOH和TPyNO2(50 μM)的紫外吸收光谱和(b) PL光谱。(c?f) TPyOH、TPyNO2、Ce6或CV在白光(20 mW cm?2)照射下(c) DCFH荧光增强、(d) DHR123荧光增强、(e) HPF荧光增强、(f) ABDA吸光度(399 nm)变化时程图。(g) TPyOH和TPyNO2的HOMO和LUMO分布,由TD-DFT(B3LYP/6-31G(d,p))计算。(h) TPyNO2内α-PET过程示意图。(i) TPyOH和TPyNO2的光电流响应。(j) TPyNO2的ROS生成过程示意图。
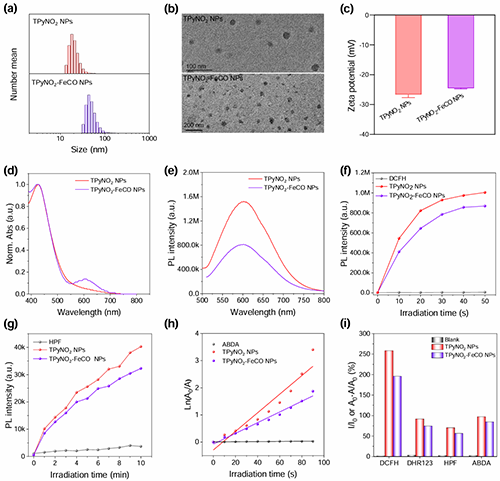
图2. (a)水动力尺寸分布,(b)透射电子显微镜(TEM)图像,(c) TPyNO2 NPs和TPyNO2?FeCO NPs的ζ电位。(d) TPyNO2 NPs和TPyNO2?FeCO NPs在超纯水中的归一化吸收光谱。(e) TPyNO2 NPs和TPyNO2?FeCO NPs在超纯水(基于TPyNO2, 10 μM)中的PL光谱。激光照射TPyNO2 NPs和TPyNO2?FeCO NPs (基于TPyNO2,10 μM)时(f) DCFH荧光增强,(g) HPF荧光增强,(h) ABDA吸光度下降的时间图。(i) TPyNO2 NPs和TPyNO2?FeCO NPs的ROS生成总述。
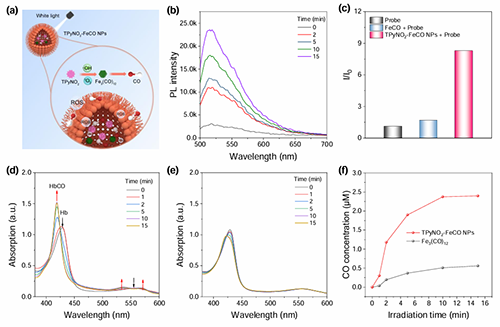
图3. (a)双模ROS刺激下TPyNO2?FeCO NPs释放CO的示意图。(b) TPyNO2?FeCO NPs存在下CO探针在白光(50 mW cm?2)照射下的PL光谱。(c)通过探针FL-CO-1荧光增强因子(I/I0)比较不同组间CO的释放情况,其中I和I0分别为FL-CO-1光照前后的PL强度。(d)在TPyNO2?FeCO NPs存在下,Hb(4.2 μM)在白光照射下的吸收光谱变化。(e) Hb(4.2 μM)在Fe3(CO)12存在下的白光吸收光谱变化。(f)不同组别的有关一氧化碳释放情况。
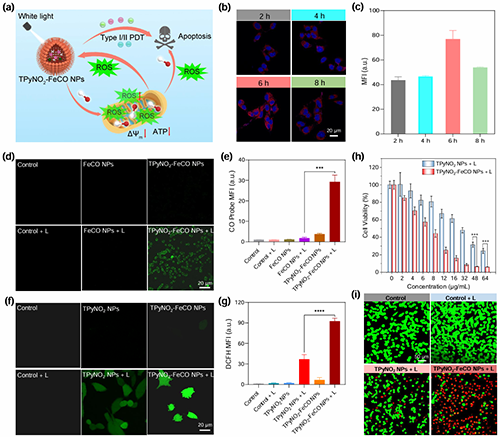
图4. (a)可控白光照射TPyNO2?FeCO NPs和I/II型PDT和CO气体协同烧蚀引发的特定ROS-CO-ROS回路示意图。(b)与TPyNO2?FeCO NPs孵育不同时间的MB49细胞的CLSM图像。(c)基于(b)图像的半定量分析红色荧光强度(FLI)。(d)使用CO荧光探针(FL-CO-1)检测MB49细胞中的CO释放。(e)基于(d)图像的绿色荧光强度半定量分析。(f) DCFH-DA获取的MB49细胞内ROS检测。(g)根据(f)中的图像对DCF绿色荧光强度进行半定量分析。(h)不同浓度的TPyNO2 NPs或TPyNO2?FeCO NPs孵育后MB49细胞的细胞活力,然后进行光照。(i)不同处理后的活细胞/死细胞染色,使用钙黄素- AM(活细胞绿色发射)和碘化丙啶(死细胞红色发射)测定。
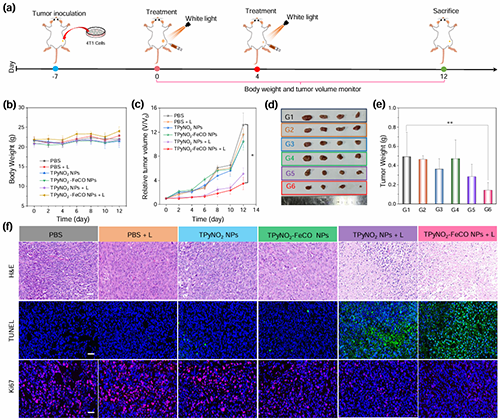
图5. (a)体内抗肿瘤实验示意图。(b)处理后小鼠平均体重变化。(c)不同处理后12天肿瘤体积生长曲线。(d)第12天小鼠肿瘤的代表性照片。(e)治疗12天后小鼠肿瘤的重量。(f)不同处理后肿瘤组织H&E、TUNEL、Ki67染色分析。标尺= 100 μm。(G1)PBS, (G2) PBS + L, (G3) TPyNO2 NPs, (G4) TPyNO2?FeCO NPs, (G5) TPyNO2 NPs + L, (G6) TPyNO2?FeCO NPs + L。
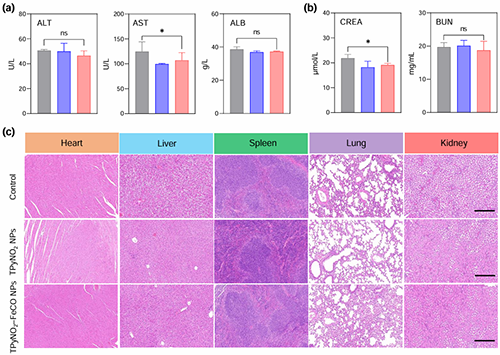
图6. (a)肝脏功能标记物,(b)肾功能标记物,(c)健康BALB/c小鼠经静脉注射PBS(灰色)、TPyNO2 NPs(蓝色)或TPyNO2?FeCO NPs(红色)(1 mg/mL,100 μL /只小鼠)7天后的主要器官H&E染色切片的组织学分析。标尺:200 μm。
以上成果发表在ACS Nano期刊上。论文题目是“Dual-Mode Reactive Oxygen Species Stimulated Carbon Monoxide Release for Synergistic Photodynamic and Gas Tumor Therapy”。该研究得到了国家自然科学基金、广东省自然科学基金、广东省分子聚集体发光重点实验室基金等项目的支持。冯光雪教授和丁丹教授为通讯作者,该工作还得到了唐本忠院士的指导。华南理工大学2020级博士生俞岳文(现为江西科技师范大学化学化工学院专任教师)、和华南理工大学2021级博士生张乐作为共同第一作者完成了该项研究。
论文链接:https://pubs.acs.org/doi/10.1021/acsnano.4c10277







