帕金森病(PD)是最常见的神经退行性疾病之一,以多巴胺能神经元进行性损伤和黑质(SN) α-突触核蛋白(α-syn)异常积累为主要特征。过度激活的脑免疫微环境是PD快速进展的关键因素,由脑内常驻小胶质细胞的神经炎症和脑外周免疫细胞的持续浸润共同推动。为解决脑内过度激活的小胶质细胞中产生的神经炎症问题,目前已经提出了许多策略,包括激活下游的抗炎信号通路如NF-κB或利用纳米酶的生物催化。然而,值得注意的是,如果不能及时预防神经炎症产生的源头或脑外周免疫细胞浸润引起的免疫恶化,很难达到治疗PD的目的。因此,需要综合治疗的方法以桥接脑内部和外部以重塑PD过度激活的免疫微环境。

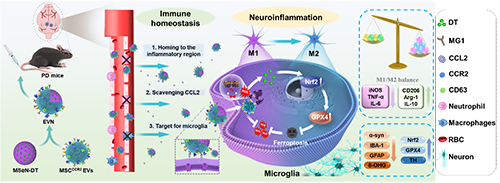
图1. 过表达CCR2的工程细胞外囊泡纳米制剂的制备及其对PD治疗的调控示意图
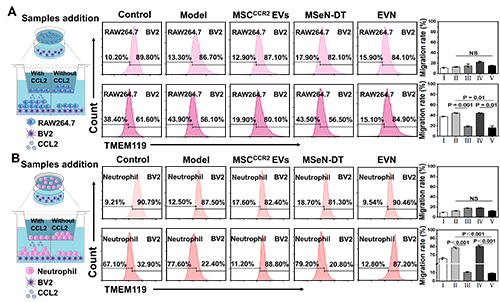
在Transwell实验中,将RAW264.7或中性粒细胞(主要外周免疫细胞)置于上腔,将不同条件下的小胶质细胞系(BV2细胞)置于下腔进行Transwell实验。结果显示,与MSCCCR2 EVs和MSeN-DT组相比,EVN组RAW264.7细胞的迁移率明显受到抑制,迁移率为16.47%(图2A)。此外,中性粒细胞向下腔的迁移也呈现出类似的趋势,表明对浸润有抑制作用(图2B)。
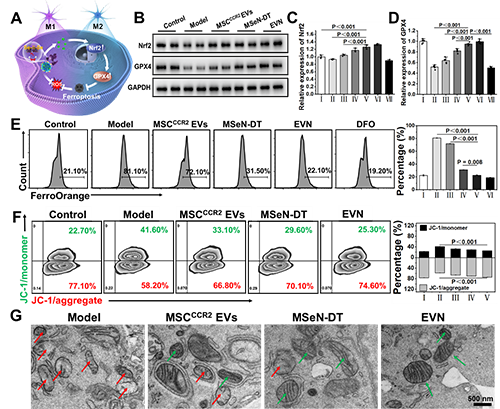
图3. EVN调节小胶质细胞表型变化的药理学机制。(A) Nrf2-GPX4信号通路示意图。(B)不同处理后BV2细胞Nrf2和GPX4表达的WB分析。(C, D)各组Nrf2和GPX4的相对表达量,其中对照组的表达量表示为1 (I:对照组,II:模型,III: MSCCCR2 EVs, IV: MSeN-DT, V: EVN, VI: tBHQ, VII: ML385, n = 5)。(E)流式细胞术检测Fe2+荧光探针染色不同条件下BV2细胞内Fe2含量的研究(I:对照组,II:模型,III: MSCCCR2 EVs, IV: MSeN-DT, V: EVN, VI:(F) JC-1流式细胞术检测不同处理后BV2细胞线粒体膜电位(I:对照,II:模型,III: MSCCCR2 EVs, IV: MSeN-DT, V: EVN, n = 3)。(G)不同处理后BV2线粒体代表性生物透射电镜图像(红箭头:线粒体脊减少,绿箭头:线粒体脊增加)
基于之前的说法,他们假设所递送的DT可以有效激活Nrf2,通过Nrf2?GPX4途径消除上游ROS的产生,抑制铁下沉(图3A)。抑制铁凋亡和阻断上游ROS生成的一个重要方面是通过EVN传递的DT完全激活Nrf2表达。本研究以Nrf2激动剂叔丁基对苯二酚(TBHQ)和Nrf2抑制剂ML385分别作为阳性和阴性对照。如图3B、C所示,EVN组通过抑制Keap1蛋白的表达,有效促进Nrf2的胞内释放。在PD患者的大脑中,细胞中GPX4的失活或减少导致脂质活性氧的产生,从而诱导小胶质细胞中的铁死亡如图3B、D所示,与对照组相比,MSeN-DT和EVN上调Nrf2和GPX4的表达。Fe2+水平升高是PD患者铁代谢异常的直接原因。
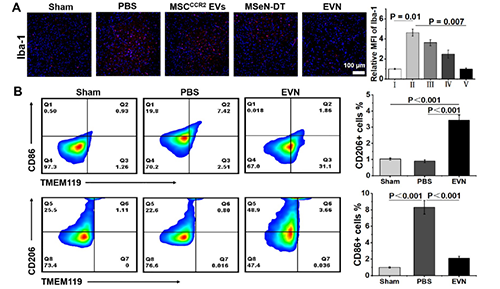
图4. EVN在体内抑制神经炎症的能力评估。(A)不同处理小鼠SN中Iba-1(红色)的代表性免疫荧光图像及相应的定量分析,其中假手术组Iba-1的相对MFI为1 (n = 3)。(B)流式细胞术研究不同处理小鼠中脑小胶质细胞表型及不同条件下小胶质细胞CD86和CD206的相应百分比(n = 3)。
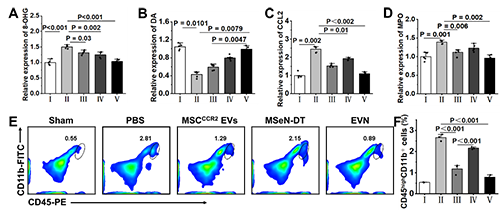
图5. EVN阻止脑外周免疫细胞浸润的体内治疗机制(A?F)不同处理小鼠脑内MPO、DA、8-OHG、CCL2的相对定量(其中假手术组的相对表达量记为1,n = 5)。(H)各组脑内巨噬细胞(CD45high、CD11b+)的流式细胞术分析和(I)定量分析。
他们将8-羟基鸟苷(8-OHG)的表达水平作为氧化损伤的标志物来评估EVN减轻PD脑氧化损伤的能力(图5A)。与模型组相比,MSCCCR2 EVs、MSeN-DT和EVN治疗组8-OHG表达水平显著降低,达到与假手术组相似的水平。这说明EVN具有较强的活性氧清除能力。多巴胺(DA)浓度是临床评价PD治疗效果的标准,如图5B所示,他们还对这些小鼠纹状体中DA的浓度进行了评估,以进一步证明EVN的治疗作用。与PBS组比较,MSCCCR2 EVs、MSeN-DT和EVN均使小鼠DA浓度升高。特别是,EVN处理小鼠的DA浓度恢复到与假手术组相似的水平。综上所述,EVN通过激活Nrf2?GPX4通路,有效抑制脑内小胶质细胞的神经炎症。进一步研究了EVN在体内抑制外周细胞浸润的能力。
原文链接:
Engineered Extracellular Vesicle-Based Nanoformulations That Coordinate Neuroinflammation and Immune Homeostasis, Enhancing Parkinson''''s Disease Therapy. ACS Nano. 2024 Aug 15. doi: 10.1021/acsnano.4c04674.
https://doi.org/10.1021/acsnano.4c04674
- 空军军医大学金岩团队《Sci.Adv.》:工程化细胞外囊泡在调节炎症和促进组织再生方面取得新进展 2020-07-23
- 天工大高辉/余云健团队 JCR:肿瘤和瘤内病原体级联靶向光热纳米制剂用于增强结直肠癌免疫治疗 2025-01-27
- 法国艾克斯-马赛大学彭玲/中国药大刘潇璇/港大黄思齐 ACS AMI:两亲性树形分子包裹的伊马替尼针对转移性卵巢癌的有效治疗策略 2025-01-06
- 安中医陈胜麒/胡容峰课题组《J. Control. Release》:新藤黄酸纳米制剂实现肝癌的自增强抗血管治疗 2023-05-09
- 西南交大鲁雄/中国海大韩璐/北京基础医学研究所江小霞等Nano Today:导电粘附水凝胶调控创伤性脑损伤后的神经炎症与神经功能 2023-07-23
