恶性肿瘤高的发病率和死亡率已严重威胁人类的健康,目前恶性肿瘤的治疗方法主要包括手术切除、放射性疗法、化学疗法等手段。迄今为止,化疗和放射治疗仍然是癌症治疗的主要方式,然而,反复多次的治疗容易产生耐药性。为提高肿瘤治疗的疗效,癌症治疗已经从单一治疗逐渐向联合治疗发展,力求达到 “1+1>2”的治疗效果。然而,联合疗法严重的副作用极大地限制了其临床应用广泛应用,如多药耐药性、低效摄取或非特异性分布等。因此,不断提高癌症治疗水平,合理设计开发高效低毒的放化疗增敏剂具有重大意义。

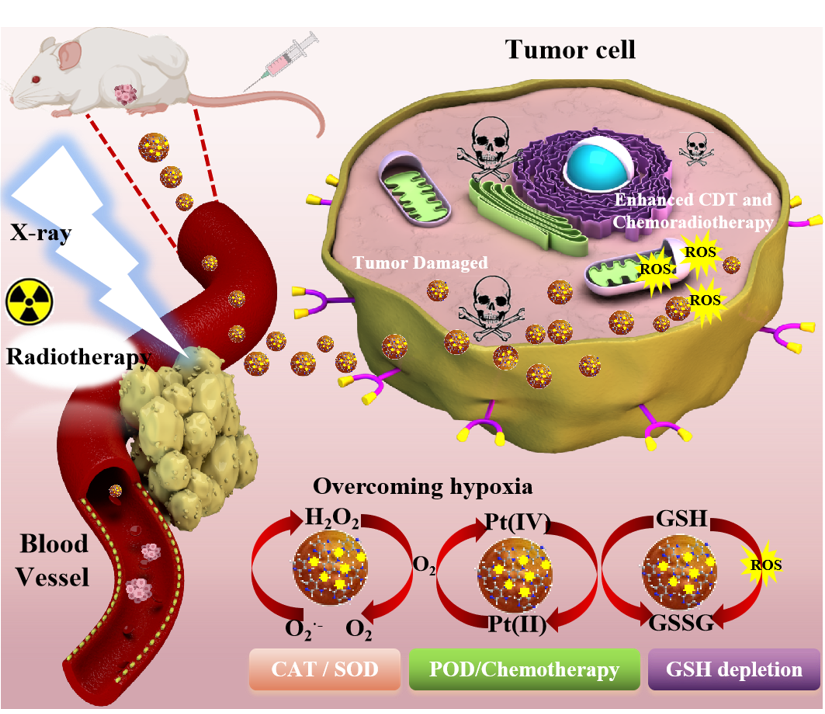
图1. PtN4C-SAzyme用于放化疗协同治疗示意图
一、PtN4C-SAzyme前药的构建和表征
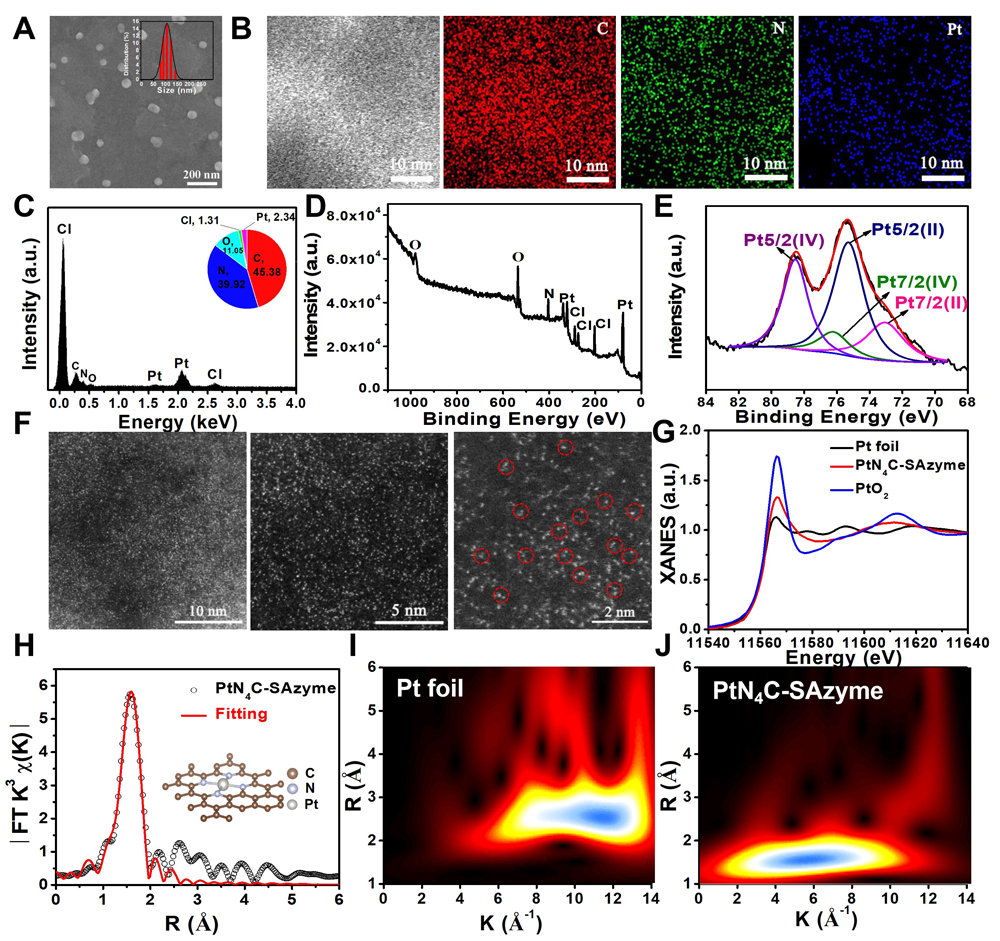
图2. PtN4C-SAzyme的结构表征
二、PtN4C-SAzyme前药的类酶催化活性检测及DFT模拟计算
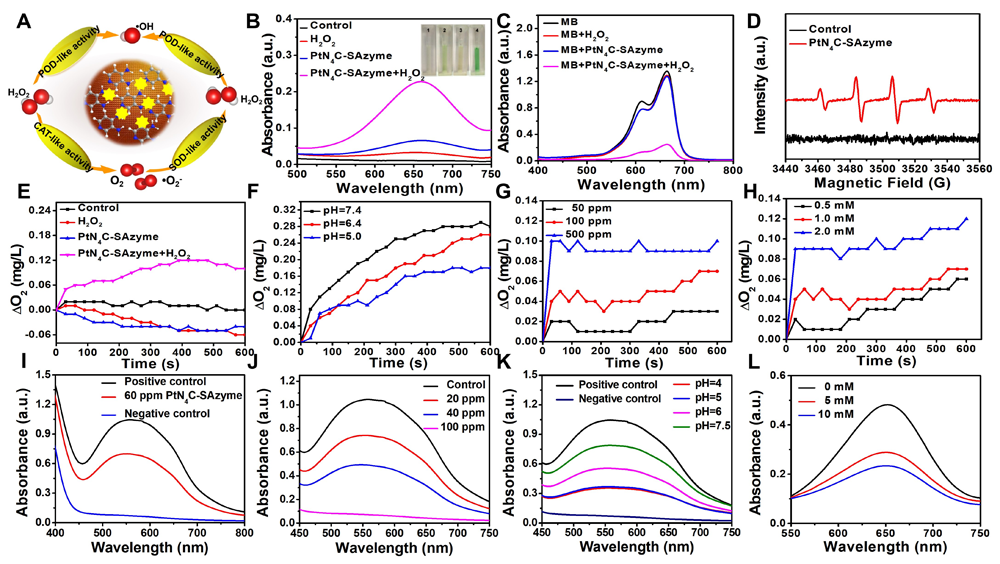
图3. PtN4C-SAzyme的多样化类酶活性检测
三、PtN4C-SAzyme前药在细胞层次上的协同抗肿瘤效果评估

图4. PtN4C-SAzyme的多样化类酶活性检测
四、PtN4C-SAzyme前药在活体层次上的抗肿瘤效果及生物安全性评估

图5. PtN4C-SAzyme体内抗肿瘤研究
五、总结
参考文献:Qiqi Xu, Yuetong Zhang, Zulu Yang, Guohui Jiang, Mingzhu Lv, Huan Wang, Chenghui Liu, Jiani Xie, Chengyan Wang, Kun Guo, Zhanjun Gu, Yuan Yong. Tumor microenvironment-activated single-atom platinum nanozyme with H2O2 self-supplement and O2-evolving for tumor-specific cascade catalysis chemodynamic and chemoradiotherapy. Theranostics. 2022. 12 (11): 5155-5171.
原文链接:https://www.thno.org/v12p5155.htm
作者简介:
雍媛,现为西南民族大学化学与环境保护工程学院教师。博士,副研究员,毕业于中国科学院高能物理研究所。主讲无机化学、材料化学、无机非金属材料等课程。在ACS NANO、NPG Asia Materials、Theranostics、ACS Applied Materials & Interfaces、Nanoscale等高水平期刊上发表论文20多篇。研究成果引起广泛关注,SCI引用超900次,4篇论文入选ESI高被引论文,并被选为封面文章和作为研究亮点被 X-MOL等科技网站进行报道。
- 四川大学袁勇教授和高会乐教授课题组 Small:构建酸响应可聚集金纳米粒用于食管癌放疗增敏和放化疗协同治疗 2022-03-11
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
- 常州大学王建浩教授团队 IJBM:负载鱼腥草囊泡的微环境响应胶原水凝胶治疗糖尿病伤口的研究成果 2025-07-14
- 浙大傅国胜/黄翯/赵静《ACS Nano》:可喷涂微环境响应型水凝胶涂层重塑内皮屏障稳态,破解介入后再狭窄难题 2025-06-04
- 上海市第一人民医院马小军/东华大学何创龙 Bioact. Mater.:TME响应复合水凝胶靶向抑制MYC驱动型骨肉瘤生长与转移 2025-01-17
