在胰腺癌中,静息态胰腺星状细胞(qPSC)的激活是导致特征性促结缔组织增生基质的关键事件。胰腺癌细胞(PCC)和激活态胰腺星状细胞(aPSC)之间的双向串扰导致的纤维化网络形成了一个复杂的肿瘤微环境(TME),大大阻碍了药物的递送和渗透。既往研究消除aPSC被认为可以降低间质流体压力和固体应力,从而增强药物对胰腺癌组织的灌注;然而,临床前研究表明,aPSC消除会加快胰腺癌进展,提高胰腺癌侵袭和转移的风险。为了改善胰腺癌的治疗,迫切需要一种阻断PCC-PSC串扰的并行性治疗策略来实现PSC静息态恢复、基质重塑和胰腺癌新联合治疗。

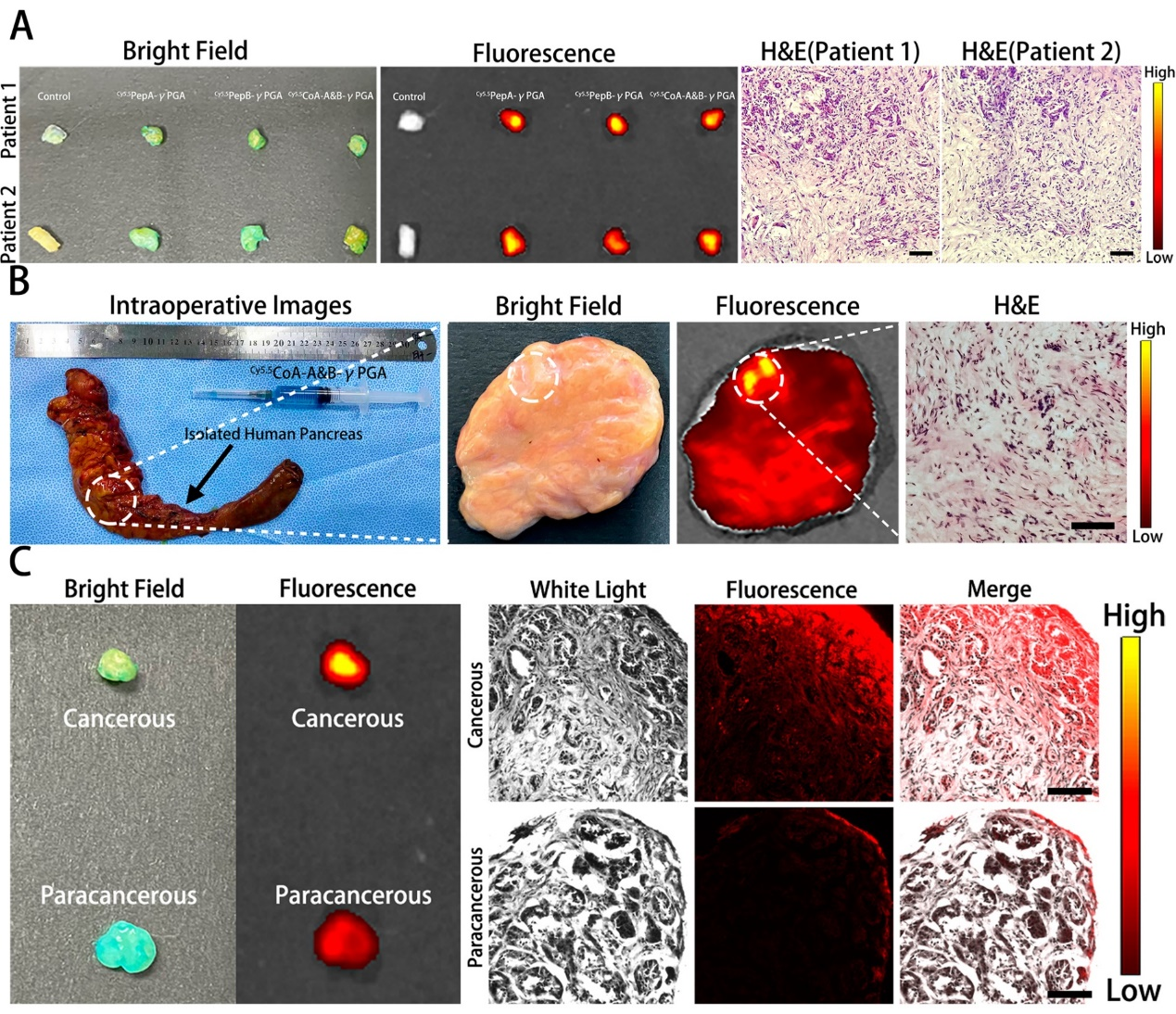
近日,南方医科大学珠江医院方驰华教授与蔡延滨副教授课题组合作在《Adv. Funct. Mater.》期刊上发表了题为“Parallelism to Conquer: Binary Supramolecular Peptide Amphiphiles Launch Synergistic Stromal Reprogramming to Remove the Baffle in Pancreatic Cancer Therapy”的文章(DOI: 10.1002/adfm.202203767)。该研究通过二元超分子肽两亲物(PAs) Met-PepA-γPGA和ATRA-PepB-γPGA的共组装,构建了一种多肽平行药物递送系统(CoA-A&B-γPGA)。在致密的胰腺癌肿瘤微环境中,CoA-A&B-γPGA可以同时靶向PCC和PSC,通过Met和ATRA的协同作用,实现了PCC旁分泌介导的PSC激活抑制和直接静默aPSC的双通路PSC静息态恢复。该药物递送系统在三维PCC/PSC细胞球和异种移植模型中表现出高渗透性和强聚集性。在有效静默aPSC和重编程促结缔组织增生基质后,序贯联合化疗显著抑制了胰腺癌的生长。此外,这种药物递送系统在检测患者样本中的胰腺癌方面显示出高度的特异性和敏感性,为深入了解胰腺癌的精准治疗提供了新的途径。南方医科大学珠江医院张玮琪博士为文章的第一作者,珠江医院方驰华教授、蔡延滨副教授和南方医院检验科战捷副教授为文章的共同通讯作者。本课题得到了国家重大科研仪器研制项目、国家自然科学基金天然数学基金重点项目、国家自然科学基金青年及面上项目、广东省基础和应用基础研究基金等的支持。

(1) 二元超分子肽两亲物(PAs)的设计与结构表征

(2) PAs分别对PCC和PSC细胞的靶向能力验证



图4:体外通过ATRA递送恢复PSC静息态。A) 与不同PAs孵育48小时后hPSCs中脂滴的尼罗红染色,沉积胶原的天狼星红染色,以及α-SMA、I型胶原蛋白、III型胶原蛋白和纤维连接蛋白的IF染色。B)与不同PAs孵育48小时后,对hPSCs中的α-SMA和I型胶原蛋白水平进行Western blot分析。C)对hPSCs中相对α-SMA和I型胶原蛋白表达进行定量分析。



图7. 皮下AsPC-1/hPSC异种移植物中的PSC静息态诱导和基质调节。A) 皮下AsPC-1/hPSC肿瘤切片的H&E染色和α-SMA、Ⅰ型胶原蛋白和纤维连接蛋白的IF染色。B) 在治疗期间监测小鼠的体重变化。C) 在治疗期间监测肿瘤生长曲线。 D) 定量分析皮下AsPC-1/hPSC肿瘤切片中相对α-SMA、Ⅰ型胶原蛋白和纤维连接蛋白的表达。

文章链接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202203767
通讯作者简介
方驰华:南方医科大学珠江医院肝胆一科主任,二级教授,博导,从事肝胆胰外科基础与临床工作40年,创新性地联合医、理、工专家组成交叉学科研究团队,以数字智能化诊治为核心技术,历时20年研究与转化,主持研究:(1)“十一五”和“十二五”国家“863”计划项目;(2)“十三五”国家重点研发计划数字化诊疗专项;(3)国家重大科研仪器研制项目;(4)国家自然科学基金广东省联合基金重点项目;(5)国家自然科学基金天然数学基金重点项目等。取得了一系列具有国际先进水平、部分国际领先的研究成果。在国家科学基金专项资助下,主编出版了《数字化肝脏外科学》《数字化胰腺外科学》《数字化胆道外科学》和《Biliary Tract Surgery: Application of Digital Technology》;组织制定和发表了国际专家共识1部;中国《临床诊治指南》2部、《三维可视化专家共识》8部、《技术操作及诊疗规范》1部。10篇论文分别获评“F5000”及“中华医学百篇优秀论文”。此外,方驰华教授以第一完成人分别获2011年广东省科技进步一等奖,2014年中国产学研合作创新成果奖,2016年广东省科技进步二等奖和2019年广东省科技进步一等奖,2021年四川省科技进步一等奖。获得国家发明专利5项,软件著作权2项,获CFDA认证1项。
蔡延滨:南方医科大学珠江医院心内科心脏中心副教授,硕士生导师,广东省药理学会心血管专委会常委,广东省病生学会心血管青年委员会委员,主要从事小分子多肽水凝胶体系及其生物医学应用的研究,具体包括:基于自组装多肽的新型抗癌纳米药物;多肽自组装的纳米荧光探针的构建及其在生物检测中的应用;多肽自组装材料及生物相容性水凝胶材料在心血管疾病中的应用。以第一或通讯作者在J. Am. Chem. Soc., Angew. Chem. Int. Ed., Biomaterials, Bioact. Mater., Chem. Eng. J., Composites, Part B等学术期刊上发表SCI论文20余篇。主持多项国家自然科学基金及广东省自然科学基金项目。
战捷:南方医科大学南方医院检验科副教授,硕士生导师,广东省药理学会心血管专委会委员,主要从事基于多肽的小分子纳米材料在疾病早诊早疗中的应用研究。以一作或共同通讯作者发表SCI论文10余篇,授权国家发明专利1项,获得国家“博士后创新人才计划”的支持,主持国自然青年基金及广东省自然科学基金项目。担任Adv. Sci.,Nano Lett.,Chem. Commun.等多个学术期刊的审稿专家。
