北京化工大学生命科学与技术学院刘惠玉教授团队首次开发了一种介入光热疗法增强125I短距离放疗协同治疗技术。相关成果发表于《Advanced Science》(DOI: 10.1002/advs.201801507)。北京化工大学张凤荣同学为第一作者,刘惠玉教授为通讯作者。
光热-放疗技术是种缓解缺氧放疗抗性、诱导肿瘤细胞特异性凋亡的有效策略。然而,近红外激光有限的组织穿透和高剂量辐射严重阻碍了光热-放疗技术在深部肿瘤中的应用。
为克服上述弊端,刘惠玉教授课题组开发了一种光热介入疗法增强的125I短距离放疗协同治疗技术(IPT-RT)。借助于一种兼具放疗增敏与近红外区域吸收特性的蜂窝状纳米多孔脂质体金(HGNs),首次实现内源性放疗与热疗技术相结合。与传统的外源型放疗增敏协同光热疗法相比(PT-RT),该技术治疗深部肿瘤具有如下优势:
(1)内置放射125I粒子可有效避免外界高剂量电离辐射对正常组织的损伤,同时增强放射线在肿瘤部位的沉积;
(2)光热介入疗法可进入腹腔深部进行局部照射治疗,避免了传统光热疗法经皮照射造成的激光功率衰减;
(3)多孔脂质体金纳米颗粒可在模拟溶酶体液中实现24 h内彻底降解为小于5 nm的颗粒。
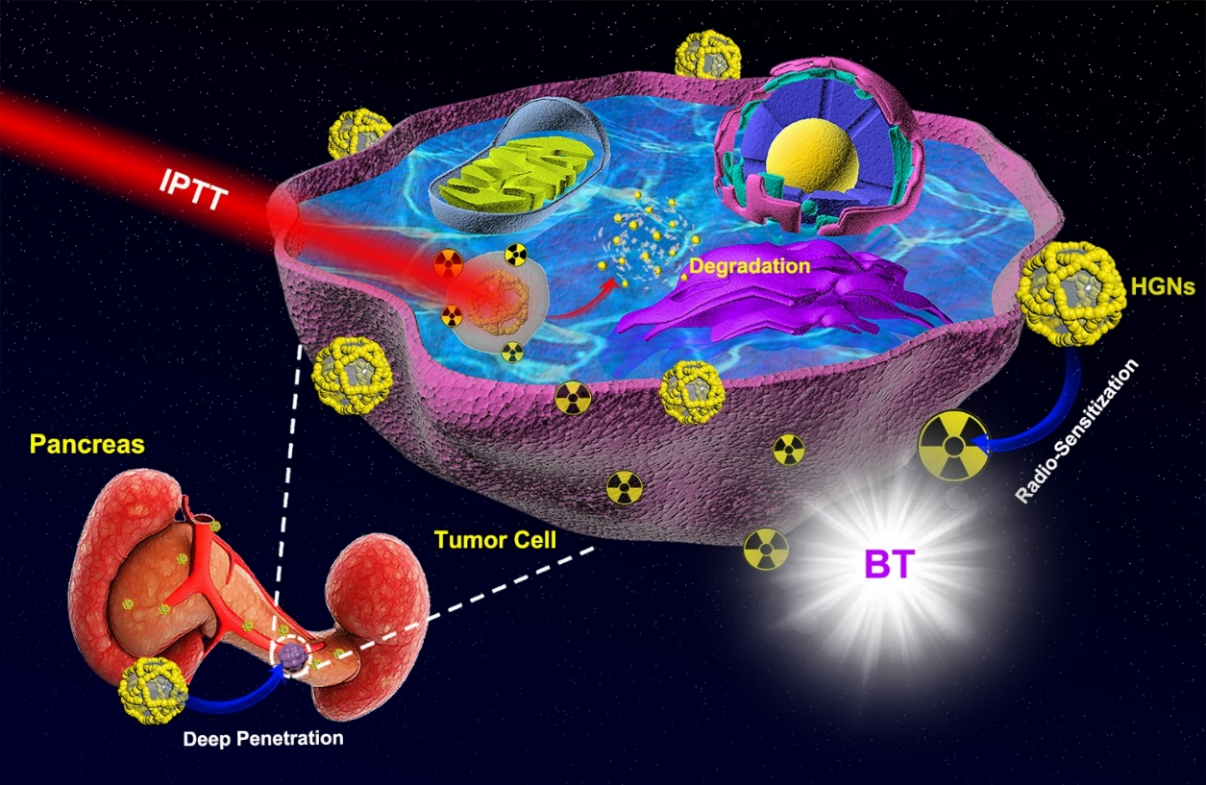
图1.光热介入治疗协同短距离放疗胰腺癌的设计思路
体外性能研究

图2.体外光热性能与放疗增敏性能探究
要点:所构建的HGNs为一种分散性好、近红外光吸收截面较大、X射线散射能力强的多功能纳米材料,通过在SW1990与PANC-1两种胰腺癌细胞系上双重验证,HGNs介导的PT-RT协同疗法可达到70%的细胞杀伤效果,在杀死PC细胞方面具有巨大潜力。
体内机制探究

图3.体外联合治疗效果探究
要点:经在SW1990原位胰腺癌模型中的机制探索,该联合疗法能通过有效改善恶性肿瘤乏氧,增强材料的瘤内渗透,提高X射线致死性,诱发DNA双链断裂并遏制肿瘤生长,抑瘤率高达96.6%,展现出优异的协同肿瘤效果。
在该研究中,作者巧妙设计了一种光热介入治疗协同短距离放疗技术,借助可生物降解蜂窝状金纳米颗粒为内源光热剂和放射增敏剂,在SW1990原位胰腺癌为代表的深部肿瘤进行验证,实现了96.6%的高肿瘤抑制率。相信这一策略可为深部恶性肿瘤的治疗开辟新的研究思路,并为PT-RT的临床转化起到推动性作用。
刘惠玉教授,北京化工大学博士生导师,国家优秀青年科学基金获得者。课题组长期致力于纳米生物材料制备基础与结构调控,抗癌诊治等健康工程应用,研究成果相继刊发在Adv. Mater., 2018, 30, 1800180. Adv. Mater., 2017, 1700448, Adv. Mater., 2016, 28, 8379-8387, Adv. Mater., 2012, 24, 755-761, Adv. Funct. Mater., 2016, 26, 4252–4261, ACS Nano, 2018, 12, 9022-9032, ACS Nano 2015, 9, 1788-1800, Angew. Chem. Int. Ed., 2011, 50, 891-895等期刊上,为相关领域的发展提供了理论和技术指导。课题组网页:http://www.liuhuiyugroup.com
论文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/advs.201801507
- 东华大学史向阳教授/沈明武研究员团队 AFM: 双驱动纳米马达用于高效肿瘤光热治疗及治疗后炎症缓解 2025-03-17
- 香港科大唐本忠院士团队/武大王富安课题组 JACS:设计一种AIE螺环近红外发射探针用于DNAzyme敏化增强的乳腺癌光热治疗 2024-12-14
- 北航潘曹峰教授/河南大学曹瑞瑞副教授团队 AFM:用于运动能量收集和光热治疗的摩擦电功能纺织品 2024-12-07
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
- 福大林立森/新国大陈小元 Nature大子刊:当手性水凝胶遇上细胞膜仿生-可术后空腔植入的生物杂化水凝胶如何调节肿瘤干细胞信号 2025-12-30
- 苏州大学冯良珠教授、刘庄教授团队 AFM:温敏催化水凝胶助力酶触“破膜+氧化应激”级联肿瘤消融新策略 2025-12-04
- 喻翠云/魏华团队 ACS Nano:基于二甲双胍的多功能纳米平台作为DNA损伤放大器 - 用于最大化放射免疫治疗以克服放疗耐药 2025-04-14
