放射治疗是临床肿瘤治疗的主要手段之一,70 %以上的肿瘤患者在病程的不同阶段需要接受放射治疗。在临床中,放疗增敏剂常用于增强放疗的治疗效果,从而避免高剂量辐照对人体的损伤,但目前常用的放疗增敏剂多为小分子药物,这些药物缺乏良好的肿瘤靶向性,存在较大的毒副作用,在临床应用中受到限制。为了提高肿瘤的靶向性,基于EPR效应的新型纳米放疗增敏剂近年来得到研究者的关注。然而,实际应用中多种生物屏障和肝/肾的清除限制了纳米材料的渗透和滞留能力,导致其难以在肿瘤部位聚集。因此,设计能够克服生物屏障、高效递送抗肿瘤纳米粒的新策略是纳米医学取得积极治疗效果的关键。周民研究员团队前期研究基础研发了光激活纳米载药系统,实现了光响应纳米系统化疗/光热协同治疗(Adv. Funct. Mater. 2018, 201801738), 光响应药物肿瘤深层组织输送(Adv. Funct. Mater. 2018, 28, 1704634), 激光诱导形变纳米材料增强肿瘤放疗(Biomaterials 2019, 219, 119369),以及规模化放疗增敏纳米药物制备( Biomaterials 2020, 226, 119538)。
近日,浙江大学转化医学研究院周民团队在利用肿瘤微环境特殊性质,在乳腺癌放射治疗方向取得了进展,其研究论文于近日被期刊《Biomaterials》接收,标题为 “Multistage-Responsive Clustered Nanosystem to Improve Tumor Accumulation and Penetration for Photothermal/Enhanced Radiation Synergistic Therapy”。该工作基于超小金纳米簇,构建了具有肿瘤环境多级响应能力的靶向药物递送系统 (缩写为Cs-Au-ICG NPs)。这种新型的纳米系统可以在不同环境下实现粒径的多级改变,从而同时提高纳米粒的靶向性与肿瘤渗透能力。此外,Cs-Au-ICG NPs还结合了荧光/光声双模态成像功能与光热/放疗联合治疗能力,具有良好的临床应用前景。
纳米粒的肿瘤聚集和穿透能力在很大程度上取决于尺寸大小。例如粒径在100纳米左右的金纳米粒循环时间较长,但只能渗透到一小部分外围的肿瘤组织。相反,小尺寸纳米颗粒的肿瘤渗透能力更强。特别是粒径为5纳米左右的金纳米簇(Au NCs),相比传统的金纳米粒具有更好的肿瘤渗透能力,在放射治疗中有很大的应用潜力。但由于尺寸较小,金纳米簇会被肝/肾快速清除,在肿瘤内滞留时间较短,限制了其治疗效果。

图1. 多级响应纳米团簇系统Cs-Au-ICG NPs介导肿瘤协同治疗示意图
通过联合超小金纳米簇与pH敏感的羧甲基壳聚糖,本研究设计了一种多级响应的纳米系统,旨在通过多次粒径的变化克服单一粒径纳米粒在肿瘤递送过程中所面临的困境,提高纳米粒的肿瘤聚集与渗透能力。如图1所示,首先,这种具有特定粒径(初始尺寸约50 纳米)的纳米系统能够进行长时间的血液循环并利用EPR效应在肿瘤组织有效聚集。随后,在酸性的肿瘤微环境下,这些pH响应的纳米粒在肿瘤内聚集形成大尺寸的团聚体(约1000纳米),并表现出强大的肿瘤滞留能力。最后,光热处理将这些聚集物进一步分散为超小金纳米团簇(约5纳米),从而提高其肿瘤渗透的能力,并通过放疗增敏作用增强最终的放射治疗效果。
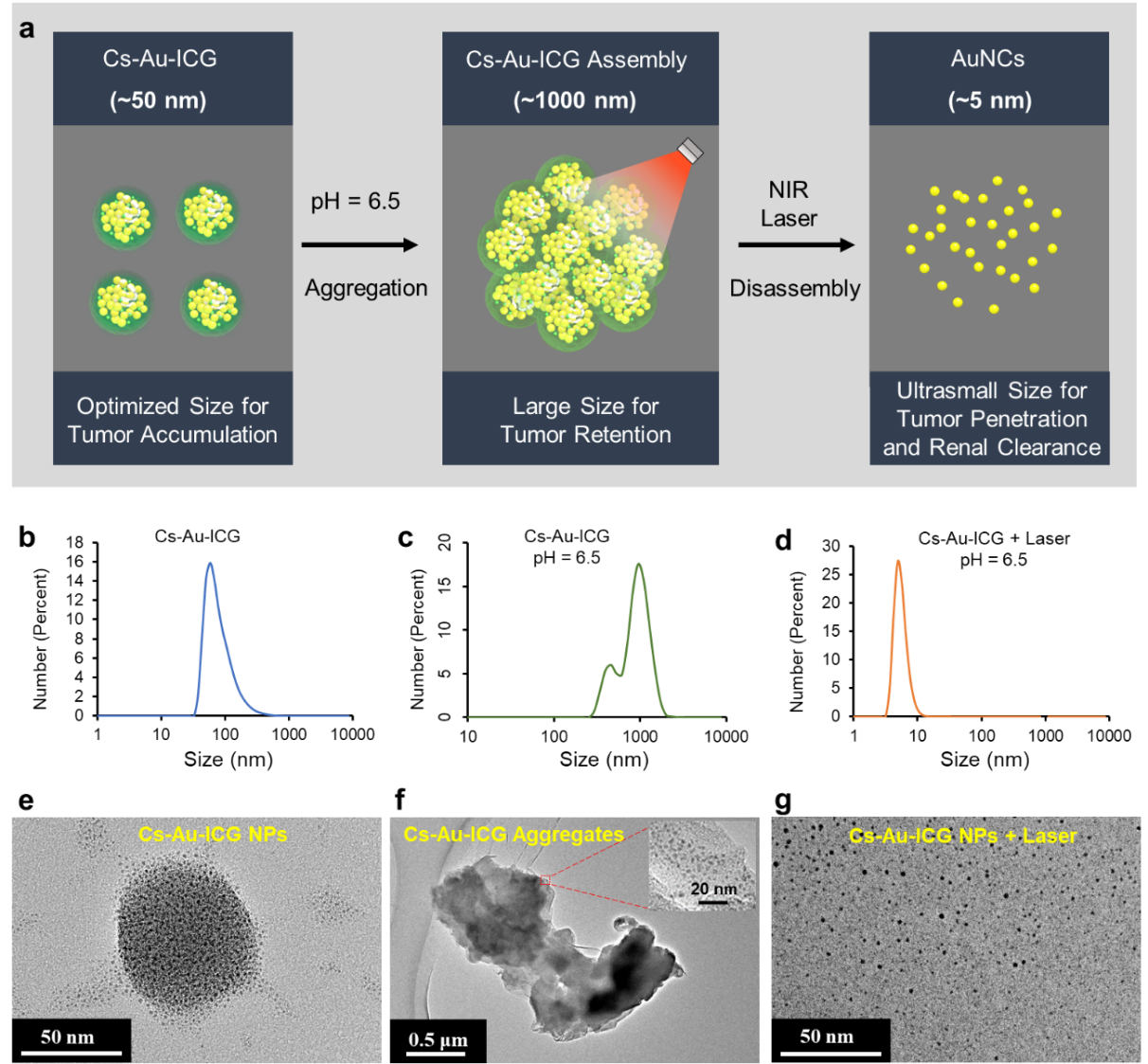
图2. Cs-Au-ICG NPs的pH/激光具有多级响应能力
动态光散射(DLS)和透射电镜(TEM)的实验结果验证了Cs-Au-ICG NPs的多级响应能力(图2)。在pH= 6.5左右的酸性条件下,Cs-Au-ICG NPs会迅速聚集为大尺寸的团聚体,粒径从58.8纳米增加到955.1纳米,表明Cs-Au-ICG NPs具有酸性响应能力,能够在酸性的肿瘤微环境下有效聚集。随后,他们使用808纳米激光照射聚集形成的团聚体。有趣的是,经激光照射后Cs-Au-ICG NPs的粒径再次发生改变,最终从1000 纳米左右的团聚体分散为5纳米左右的金纳米团簇,表明光热处理可以进一步调整纳米粒的尺寸,这对纳米粒的肿瘤靶向与渗透能力有重要影响。
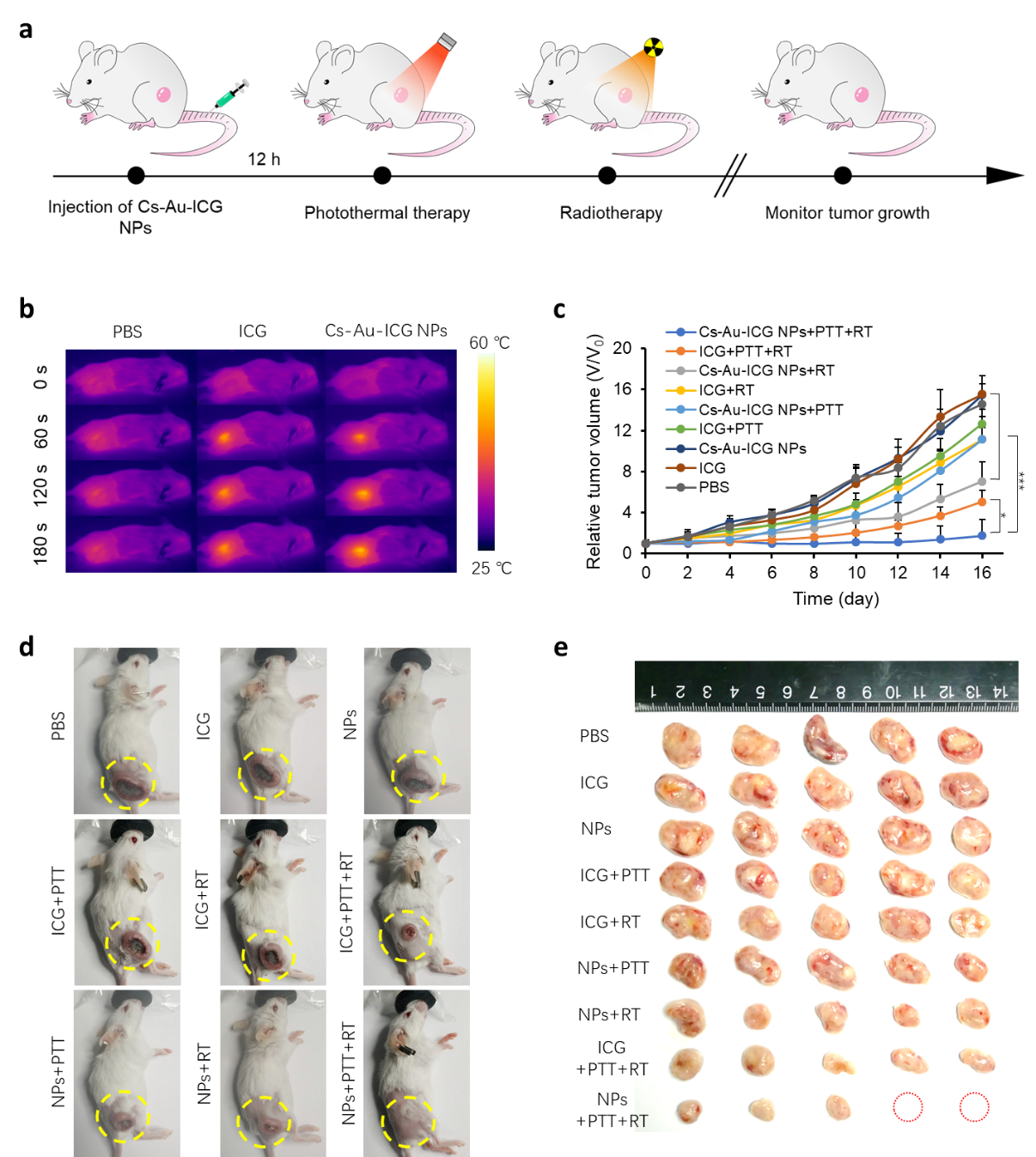
图3. 多级响应多级响应纳米团簇系统肿瘤协同治疗效果
Cs-Au-ICG NPs的体内治疗效果通过4T1皮下肿瘤模型进行测定。图3b表明相比于游离的ICG,多级响应的Cs-Au-ICG NPs在肿瘤能够更好的聚集,从而产生更强的光热效应。图3c-e为16天内小鼠瘤径的体积变化及代表性的肿瘤照片。结果显示,相比于对照组,治疗组肿瘤的生长明显受到抑制,表明多级响应的Cs-Au-ICG NPs具有良好的协同治疗效果。
综上所述,Cs-Au-ICG NPs在pH/激光作用下可以发生粒径的多级改变,从而有效靶向肿瘤部位,在4T1皮下肿瘤模型中,NPs注射小鼠的肿瘤部位产生清晰的荧光/光声信号,并且NPs/PTT/RT处理小鼠的肿瘤生长和肺/肝转移受到明显抑制。这种pH/激光触发的多级响应纳米系统显示出强大的肿瘤聚集和渗透能力,并具备良好的双模态成像功能与放疗/热疗协同抗肿瘤能力,在肿瘤治疗方面表现出良好的应用前景。
论文第一作者是浙江大学硕士生华诗远,课题组博士生何健是论文的共同作者,浙江大学周民研究员是论文的唯一通讯作者。该研究工作得到了得到了国家重点研发计划、国家自然科学基金、浙江省重点研发计划等项目资助。
论文网址:https://www.sciencedirect.com/science/article/pii/S014296122030836X
课题组主页:https://person.zju.edu.cn/mi
- 江南大学付少海/王冬团队 Small:原位矿化生成的双网络结构壳聚糖复合气凝胶用于替代石油基保温材料 2025-10-27
- 暨大刘明贤教授团队 Bioact. Mater.: 纳米粘土增强的3D打印壳聚糖水凝胶用于止血与感染伤口修复 2025-08-28
- 新疆大学吐尔逊·阿不都热依木教授团队 J. Hazard. Mater./CEJ:壳聚糖基分子印迹电化学传感器的构筑及其性能研究 2025-08-06
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
- 东南大学葛丽芹教授与合作者 Research:微气泡为模板的免疫活性金属多酚胶囊用于药物递送和增强的肿瘤免疫治疗 2025-07-31
- 四川大学丁明明教授团队 Angew: 可视化β折叠到β转角构象转变的荧光聚合物囊泡及其用于颜色报告型药物递送 2025-07-11
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
