近日,上海交通大学医学院附属仁济医院上海市肿瘤研究所段友容教授团队和风湿免疫科沈南教授团队合作在国际学术期刊ACS Nano发表了题为“MicroRNA-125a Loaded Polymeric Nanoparticles Alleviate Systemic Lupus Erythematosus by Restoring Effector/Regulatory T Cells Balance”的研究论文,通过纳米递送系统递送miRNA至T细胞,重塑效应T细胞和调节T细胞平衡治疗系统性红斑狼疮,显示了明显的治疗效果和良好的安全性。该研究为系统性红斑狼疮的精准治疗提供了新的策略。
系统性红斑狼疮(Systematic Lupus Erythematosus,以下简称SLE)是一种复杂的系统性自身免疫病,导致全身多系统和脏器损害,也被称为“不死的癌症”。非特异性的免疫抑制剂和抗炎症药物是目前主要的治疗手段。但是此类药物不良反应大,药物引起导致的器官和组织损伤在某些情况下可能已经超过了疾病本身对患者产生的伤害。SLE病因复杂,效应性/调节性T细胞的失衡是SLE 发生发展的关键病因。miRNA 作为一种负调控分子参与包括T细胞在内的大部分免疫细胞的分化和免疫应答的各个环节。miRNA 的异常表达与包括系统性狼疮在内的多种自身免疫疾病的发病密切相关,因此,miRNA 在机体中对免疫细胞的调节作用是 SLE 药物开发的极好靶点。
沈南教授课题组前期发现miR-125a于SLE患者和相关小鼠模型的T细胞中表达显著下调,且miR-125a可以稳定调节T细胞介导的免疫稳态。本工作以单甲氧基(聚乙二醇)-聚(D,L-丙交酯-co-乙交酯)-聚(L-赖氨酸)(mPEG-PLGA-PLL,PEAL)为载体,构建载miR-125a的纳米递送系统(PEALmiR-125a)。该系统能保护miR-125a不被降解,从而延长miR-125a在体内的循环时间。证实PEALmiR-125a能够有效的递送miR-125a至原代T细胞,其中对激活的T细胞转染效率更高。来源于SLE模型小鼠(MRL/lpr)脾脏T细胞对纳米粒的摄取能力显著高于正常对照小鼠(MRL/MpJ)的脾脏T细胞。体内摄取实验也证实PEALmiR-125a更易被SLE小鼠的脾脏T细胞摄取。T细胞的过度激活是SLE的主要病理特征,这无疑给PEALmiR-125a纳米系统治疗SLE带来了天然的优势。纳米粒的体内生物分布显示与健康小鼠相比,PEALmiR-125a纳米粒更易富集于SLE模型小鼠病理性脾脏中。脾脏作为最大的免疫器官,在自身免疫病的发病中发挥了关键作用。在MRL/lpr小鼠的病理性脾脏中65-80%脾脏细胞为T细胞,而正常小鼠中T细胞占比为20-30%。因此PEALmiR-125a纳米粒在病理性脾脏中的高度富集给其在SLE的治疗产生了积极作用。
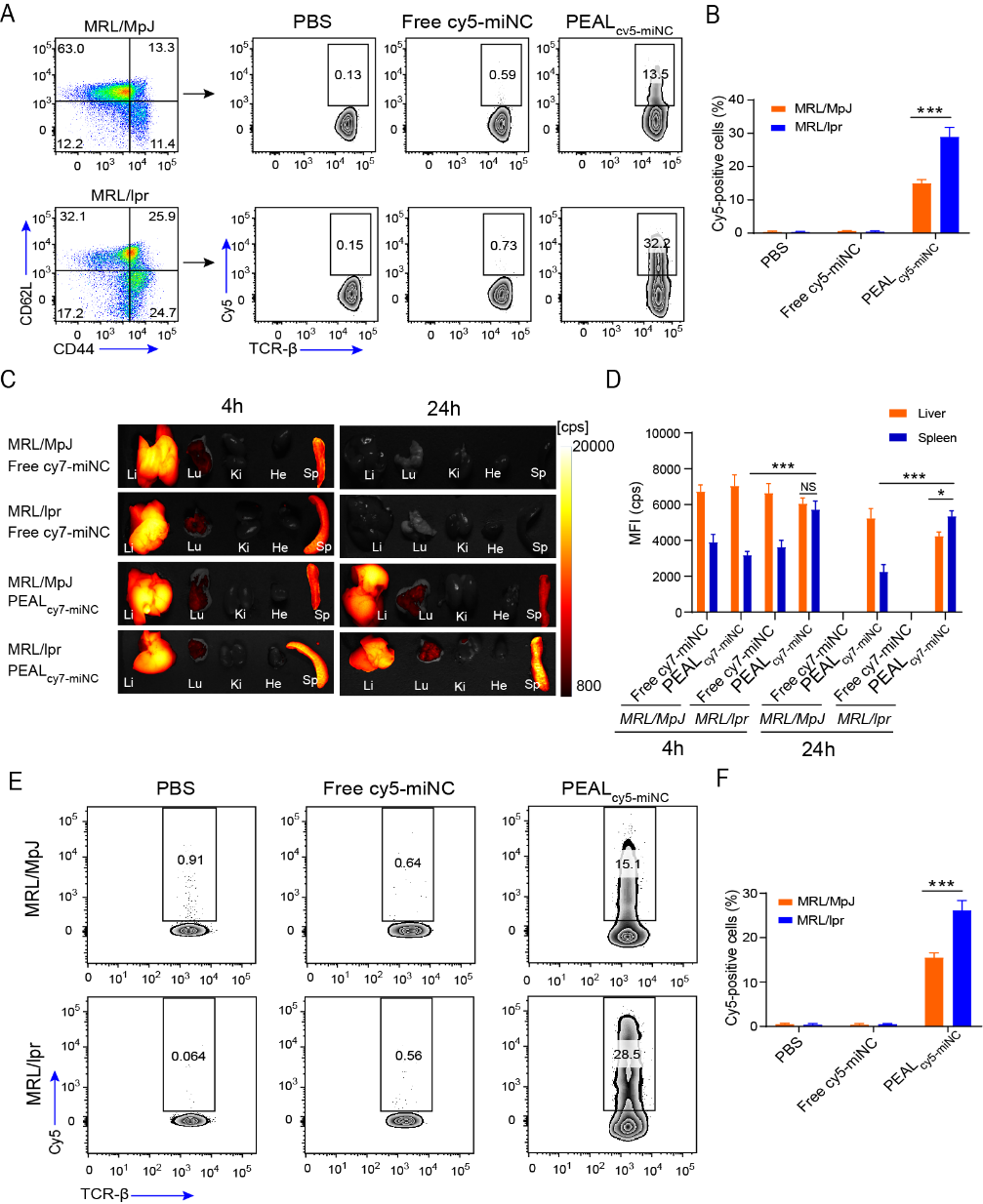
图1.(A) 体外SLE小鼠或正常小鼠的脾脏T细胞对纳米粒的摄取。(B)图A的统计分析。(C) 纳米粒在SLE小鼠和正常小鼠的体内生物分布。(D)图C中各脏器平均荧光强度的统计分析。(E)体内SLE小鼠和正常小鼠T细胞对纳米粒的摄取。(F)图E的统计分析。
PEALmiR-125a的治疗效率与当前最主要的治疗药物非特异性免疫抑制剂地塞米松相当,但是明显改善了地塞米松的副作用。更重要的是PEALmiR-125a纳米粒能够重塑效应T细胞和调节性T细胞之间的平衡,从而减缓SLE的发展,而相同剂量的游离miR-125a agomir无明显疗效。与传统的SLE治疗药物非特异性免疫抑制剂比较,PEALmiR-125a纳米粒通过恢复免疫稳态来改善SLE,不会破坏机体的免疫功能,具有良好的治疗安全性。
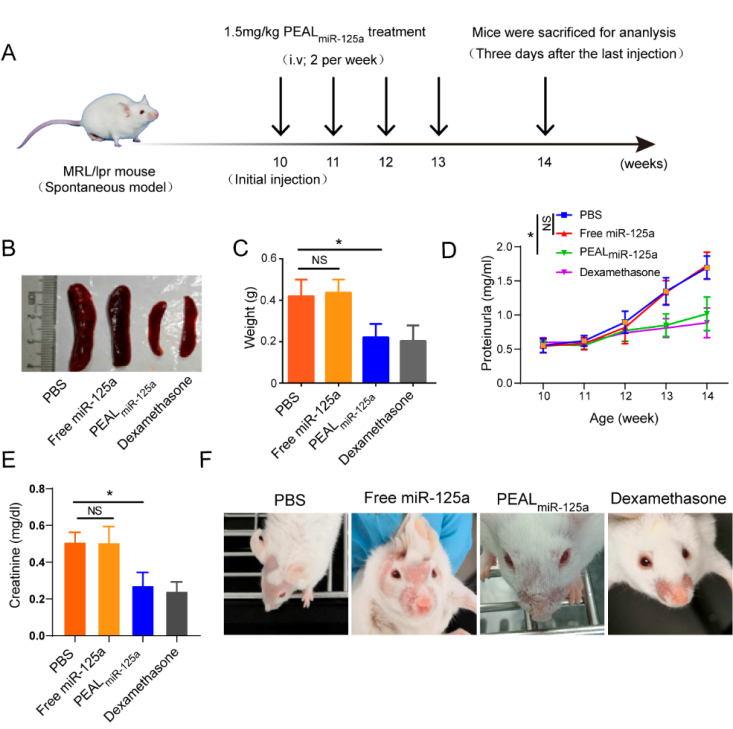
图2.(A)动物实验方案。(B) 代表性的脾脏大小的图。(C)脾脏大小的统计图。(D)尿蛋白水平。(E)血清肌酐水平。(F)代表性的皮损图片。

图3.纳米粒的构建及体内作用机制
以上研究成果发表于国际学术期刊ACS Nano。段友容课题组的助理研究员张佳利博士和博士研究生陈传荣为该文章的共同第一作者,上海交通大学医学院附属仁济医院上海市肿瘤研究所的段友容教授、上海交通大学医学院附属仁济医院风湿免疫科沈南教授和唐元家副教授为文章的通讯作者。
该工作受到上海市卫健委(No.20194Y0135)和上海市肿瘤研究所硕博基金(No.SB19-07)等项目的资助。
论文信息:Jiali Zhang, Chuanrong Chen, Hao Fu, Jian Yu, Ying Sun, Hui Huang, Yuanjia Tang*, Nan Shen*, YourongDuan*. MicroRNA-125a Loaded Polymeric Nanoparticles Alleviate Systemic Lupus Erythematosus by Restoring Effector/Regulatory T Cells Balance. ACS Nano. DOI: 10.1021/acsnano.9b09998.
原文链接:https://pubs.acs.org/doi/abs/10.1021/acsnano.9b09998
课题组介绍
段友容教授课题组近年来主要致力于药物递送系统与转化医学领域的研究,探索了多种基于纳米技术和生物材料的肿瘤治疗新策略。将构建的纳米递送系统应用于脑胶质瘤、前列腺癌、胰腺癌、肝癌、肺癌、乳腺癌以及卵巢癌等多种耐药性肿瘤的靶向治疗研究,有一系列原创性研究成果发表(ACS Nano2016,10:11548; Advanced Functional Materials2018,28:1706;Autophagy 2017,13:1176;Chemical Engineering Journal 2020,383:123230;Biomaterials 2019,222:119442;Biomaterials 2014,35:760;Theranostics 2017,7:4424; Theranostics 2019,9:1047)。
- 四川大学何斌/蒲雨吉 ACS Nano:高分子化丁酸纳米平台治疗肠炎 2023-12-24
- 华南理工朱伟 Adv. Sci.:基于红细胞和MOF-级联酶的人工生物杂化体用于高尿酸血症治疗 2023-12-17
- 长期有效 | 西南交大周绍兵教授团队诚招博士、推免硕士 - 材料、生物医学工程 2023-09-23
- 四川大学高会乐教授 Adv. Mater.: 小胶质细胞膜包被的聚多巴胺纳米递送系统用于抑郁症的治疗 2025-01-27
- 成医杨倩/川大彭锦荣、高会乐团队 AFM:靶向清除巨噬细胞内ROS联合TRAF6靶向抑制,调控动脉粥样硬化炎性微环境,稳定斑块 2023-04-08
- 上海交大医学院庞燕团队《Adv. Drug Deliver. Rev.》综述:纳米滴眼剂 - 眼部疾病的局部无创治疗方式 2023-02-16
