细菌感染已成为全球公共卫生重大挑战。NIR-II成像引导的光热治疗是一种前景广阔的非侵入性治疗策略。然而,其疗效受限于治疗药物在感染部位积累不足以及对生物膜穿透能力有限等问题。当前的研究主要聚焦于纳米载体的尺寸、形状和表面性质对细菌生物膜渗透的影响,而载体的硬度这一重要参数在抗菌治疗中的作用尚未被充分探索。
近日,山东大学崔基炜教授和山西大学冯丽恒教授合作团队开发了一种负载J-聚集体的金属-多酚超分子纳米胶囊,可控的纳米胶囊硬度能够改善其在细菌感染部位的富集和在生物膜中的渗透能力,最终实现NIR-II成像引导的高效抗菌光热治疗。该工作的创新之处在于:制备得到的纳米胶囊具有NIR-II荧光成像和优异的光热转换效率(82.1%),并且证明了较软的纳米胶囊在感染部位具有更优异的富集效率和生物膜渗透能力,从而显著提高抗菌效果。此外,该纳米胶囊在酸性感染微环境中能够发生降解,释放出具有抗炎效果的单宁酸(TA),实现协同抗炎。该递送系统整合了NIR-II成像、高效光热治疗和抗炎三种功能,结合对胶囊硬度的调控,可有效治疗浅表或深层组织的细菌感染,为高效抗菌纳米材料的设计提供了新的思路。
2026年2月3日,相关研究成果以“Stiffness-Tunable Phenolic Nanocapsules Loaded with J?Aggregates for Near-Infrared II Imaging-Guided Phototherapy of Bacterial Infections“为题发表在ACS Nano上。山东大学化学与化工学院崔基炜教授和山西大学化学化工学院冯丽恒教授为该论文的通讯作者,山西大学田媛副教授为该论文的第一作者。
将合成的具有A-D-π-D-A结构的BTPTIC分子与8-arm-PEG-OH共组装形成了J-聚集体(BTPTIC@PEG J-aggregates),并负载到ZIF-8中制备得到BTPTIC@PEG@ZIF-8纳米颗粒作为模板,在TA的刻蚀下最终形成BTPTIC@PEG-TA纳米胶囊。通过调控TA的浓度,制备得到了具有不同硬度的BTPTIC@PEG-TA纳米胶囊,分别为BTPTIC@PEG-TA6、BTPTIC@PEG-TA3、BTPTIC@PEG-TA1和BTPTIC@PEG-TA0.5纳米胶囊(图1)。通过分子动力学模拟探究了BTPTIC与8-arm-PEG-OH在水溶液中的自组装行为,证明了J-聚集体的形成(图2)。BTPTIC@PEG-TA纳米胶囊的硬度随着胶囊壁厚的增加而增加,在830 nm处具有近红外吸收,发射波长红移到NIR-II窗口,展示出了NIR-II成像的潜力。同时,BTPTIC@PEG-TA6、BTPTIC@PEG-TA3、BTPTIC@PEG-TA1和BTPTIC@PEG-TA0.5纳米胶囊的光热转换效率相比于BTPTIC分子(44.3%)被提高至82.1%、80.3%、75.7%和72.8%,显示出优异的光热特性(图3)。在体外抗菌、抗生物膜和NIR-II活体荧光成像实验中,最软的BTPTIC@PEG-TA0.5纳米胶囊展现出最优异的杀菌效果、生物膜渗透能力和感染部位富集效率(图4,5)。结合在酸性条件下降解释放TA的性能,BTPTIC@PEG-TA0.5纳米胶囊在消除细菌生物膜的同时能够有效缓解感染部位的炎症从而促进组织修复,对小鼠细菌性生物膜伤口和肺炎均展示出有效的治疗(图6,7)。
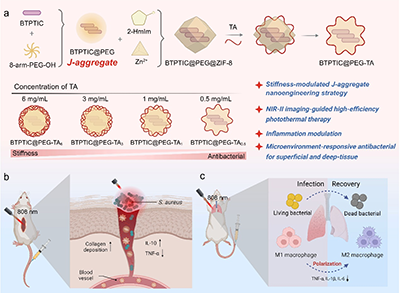
图1.(a)BTPTIC@PEG-TA纳米胶囊的制备和硬度调控示意图。(b)BTPTIC@PEG-TA纳米胶囊对细菌感染性伤口和肺炎的治疗效果。
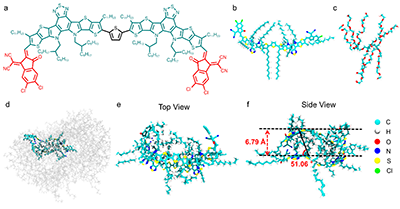
图2.(a)BTPTIC的分子结构。(b)8-arm-PEG-OH和(c)BTPTIC在分子动力学模拟中的结构模型示意图。(d)BTPTIC和8-arm-PEG-OH组装后的图片。BTPTIC聚集体的(e)俯视图和(f)侧视图。
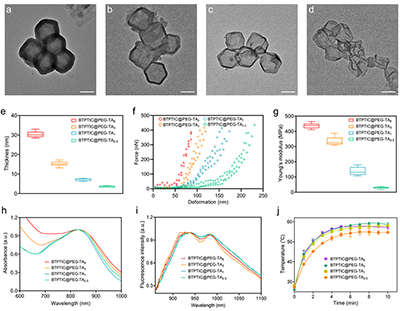
图3.(a)BTPTIC@PEG-TA6、(b)BTPTIC@PEG-TA3、(c)BTPTIC@PEG-TA1和(d)BTPTIC@PEG-TA0.5纳米胶囊的TEM图片。比例尺为150 nm。(e)BTPTIC@PEG-TA纳米胶囊的壁厚。BTPTIC@PEG-TA纳米胶囊的(f)力-变形曲线和(g)杨氏模量。BTPTIC@PEG-TA纳米胶囊的(h)吸收光谱、(i)发射光谱和(j)光热升温曲线。
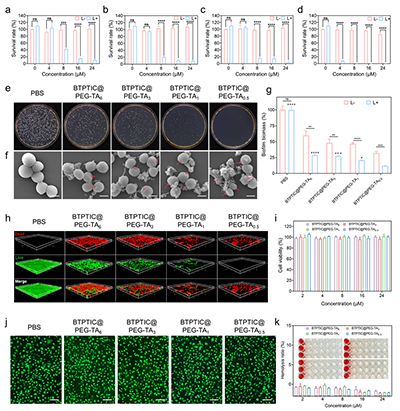
图4.经(a)BTPTIC@PEG-TA6、(b)BTPTIC@PEG-TA3、(c)BTPTIC@PEG-TA1和(d)BTPTIC@PEG-TA0.5纳米胶囊处理后金黄色葡萄球菌的存活率。(e)不同处理条件下金黄色葡萄球菌的照片及(f)扫描电子显微镜图像,比例尺为500 nm。(g)不同处理条件下金黄色葡萄球菌生物膜清除率定量分析。(h)不同处理条件下生物膜的3D共聚焦荧光显微镜图像。(i)不同处理条件下L929细胞的存活率及(j)活死细胞染色图像。绿色与红色分别代表活细胞和死细胞,比例尺为10 μm。(k)BTPTIC@PEG-TA纳米胶囊的溶血率实验。
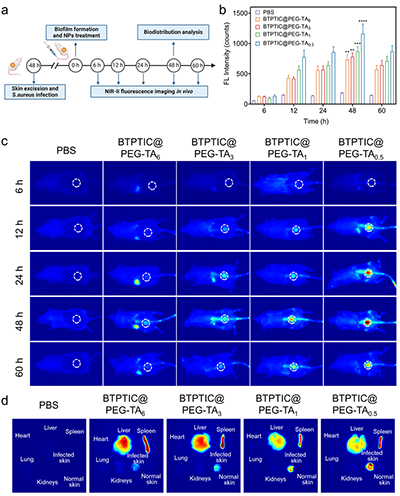
图5.(a)NIR-II活体荧光成像实验流程示意图。(b)经尾静脉注射PBS及不同硬度的BTPTIC@PEG-TA纳米胶囊后,细胞感染模型小鼠伤口部位的荧光强度统计数据及(c)对应的活体NIR-II荧光图像。(d)经尾静脉注射不同硬度的BTPTIC@PEG-TA纳米胶囊,48小时后小鼠体内的分布情况。
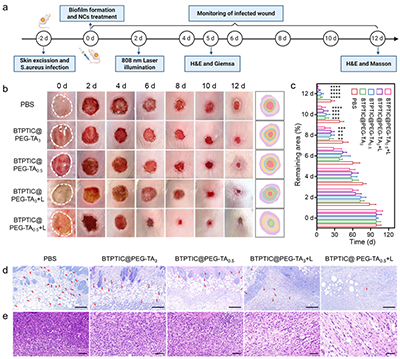
图6.(a)小鼠细菌生物膜伤口建模和治疗的流程示意图。(b)伤口愈合过程的照片和(c)伤口面积统计数据。治疗第5天伤口处组织的(d)Giemsa和(e)H&E染色图片。
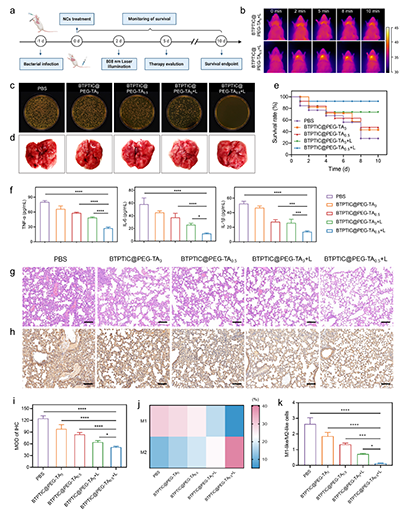
图7.(a)小鼠细菌性肺炎的模型建立和治疗流程示意图。(b)808 nm激光照射下的细菌性肺炎小鼠热成像图。(c)治疗第5天,对小鼠肺部灌洗液中的细菌进行培养后的照片。(d)小鼠肺组织照片和(e)生存率曲线。(f)不同治疗组中,小鼠血清中细胞因子水平(TNF-α、IL-1β、IL-6)。(g)不同治疗后第5天,肺组织的H&E和(h)NF-κB染色图像。(i)肺组织中NF-κB表达的定量统计数据。进行不同治疗后,肺组织中M1和M2巨噬细胞的(j)热图和(k)比例分析数据。
原文链接:https://pubs.acs.org/doi/10.1021/acsnano.5c19432
