干细胞分化过程中会动态重塑并硬化细胞外基质,从而产生具有阶段特异性的生物力学信号,引导组织发育。然而,传统生物材料旨在模拟成熟细胞外基质的硬度,因其静态、不可演化的特性,忽视了基质硬度的时空异质性。为此,研究人员开发了一种细胞程序化自适应收缩水凝胶。该水凝胶能使间充质干细胞通过碱性磷酸酶(一种早期成骨标志物)介导的亲水-疏水转变及微凝胶收缩,主动重塑其微环境。这种细胞程序化的重塑建立了局部力学异质性,并通过正反馈环路促进成骨分化。机制上,这种动态演化的基质增强了力传导相关的微小RNA表达,抑制了EZH2,并减少H3K27三甲基化,从而激活成骨转录。在体内实验中,装载间充质干细胞的CPAC水凝胶显著促进了大鼠颅骨缺损的修复。这些发现提出了一种细胞指导、动态可演化生物材料的新范式,该范式能重现天然细胞外基质的适应性,从而协调干细胞命运和组织形态发生。
2026年1月30日,相关工作以Mechanically heterogeneous hydrogel with cell-programmed network restructuring promotes tissue regeneration by mechano-epigenetic modulation为题发表在nature communications上。
研究首先合成了核心功能单元——磷酸化甲基丙烯酸羟丙酯(Phos-HPMA)微凝胶。该微凝胶表面的磷酸基团使其呈亲水性。当MSCs分泌ALP催化去除磷酸基后,微凝胶发生亲水-疏水转变并伴随显著体积收缩。这一特性是材料动态响应的基础。以此微凝胶为“动态模块”,结合修饰的透明质酸、明胶及环糊精等组分,通过光聚合构建出细胞程序化自适应收缩(CPAC)水凝胶。确保了初始的均质性与结构可演化性。
封装于CPAC水凝胶中的MSCs展现出更高的活性、增殖与铺展能力。在成骨诱导下,其早期及晚期成骨标志物(Runx2、ALP、I型胶原等)的表达均显著高于静态对照组,证明了该材料在体外能高效驱动MSCs成骨分化。
CPAC水凝胶的功能源于一个自我强化的正反馈循环:MSCs分泌ALP→触发微凝胶收缩与局部硬化→MSCs感知硬度变化并激活细胞内FAK/Paxillin等力学信号通路→活化的力学信号进一步上调成骨基因及ALP表达→更多ALP分泌驱动水凝胶进一步异质化,持续放大力学刺激与分化进程。
研究进一步深入,揭示了连接力学刺激与基因表达的表观遗传桥梁。CPAC水凝胶产生的力学异质性,特异性上调了MSCs中一组力学敏感miRNA。这些miRNA靶向抑制EZH2蛋白的表达从而抑制导致H3K27me3水平全局下降,特别是在成骨核心基因RUNX2的启动子区域,从而解除转录抑制,强力激活成骨程序。这一“力学信号-miRNA-EZH2/H3K27me3-基因激活”轴,构成了CPAC水凝胶调控干细胞命运的深层机制。
研究在大鼠临界尺寸颅骨缺损模型中评估了CPAC水凝胶的治疗潜力。影像学评估(Micro CT)、组织学评估(苏木精-伊红染色、Masson三色染色以及免疫组化染色)表明,CPAC组有更丰富的新生骨组织和胶原基质形成。这些结果充分证明,CPAC水凝胶能显著促进大块骨缺损的修复与再生。
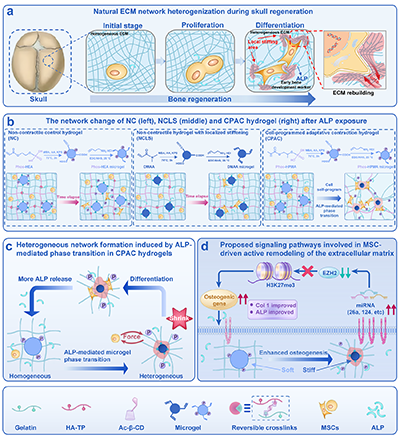
图1:具有细胞编程网络重组的力学异质水凝胶(CPAC水凝胶)通过力学表观遗传调节促进组织再生设计示意图。
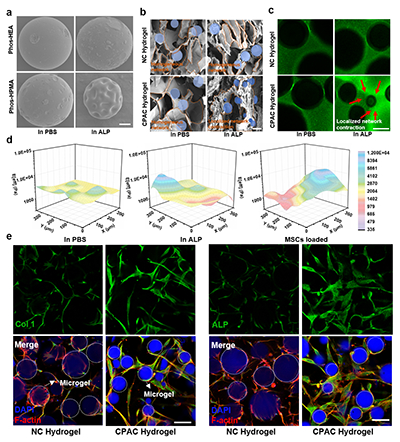
图2:(a)ALP处理前后Phos-HEA和Phos-HPMA微凝胶的SEM图像;(b)SEM和(c)共聚焦图像显示ALP处理后水凝胶网络结构的变化;(d)热图显示了(i) PBS、(ii) ALP和(iii) MSC封装处理72小时后CPAC水凝胶中局部有效杨氏模量分布。(e)Col1和ALP在NC和CPAC水凝胶中的免疫荧光染色
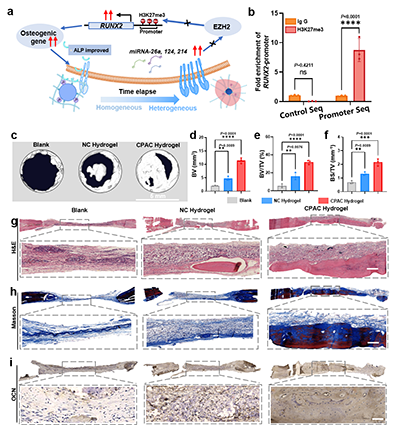
图3:(a)CPAC水凝胶产生的力学刺激调节成骨基因表达的细胞通路示意图;(b)ChIP-qPCR分析显示H3K27me3占据RUNX2的启动子位点;(c)Blank、NC和CPAC水凝胶组植入后8周的Micro CT显示骨缺损修复效果。8周后分别定量(d)骨体积(BV)、(e)骨体积/总体积(BV/TV)、(f)骨表面积/总体积(BS/TV);(g) Blank、NC和CPAC水凝胶组骨缺损的H&E染色,(h)马松三色染色。(i) Blank、NC和CPAC水凝胶组OCN免疫组化染色
结论与展望
本研究成功开发了一种革命性的细胞指令性动态生物材料——CPAC水凝胶。它突破了传统静态材料的局限,通过巧妙的分子设计,使得材料能够“读懂”并“响应”干细胞的分化状态(以ALP为信号),进而由细胞自身主导,在时间和空间上精确重构出模拟天然发育过程的力学异质微环境。这种动态重塑不仅通过激活经典力学传导通路,更通过调控miRNA-EZH2-H3K27me3这一表观遗传轴,从根本上重编程了干细胞的基因表达谱,从而高效驱动成骨分化与组织再生。
华南理工大学为论文的第一署名单位,生物医学科学与工程学院2022级博士生凌强君、中山大学附属第一医院李昊医师为论文的共同第一作者,华南理工大学边黎明教授、张琨雨副教授、赵剑阳副研究员和广东省人民医院骨肿瘤科主任张余教授为该文章的共同通讯作者。
文章链接:https://doi.org/10.1038/s41467-026-69004-z
