海洋蛋白质粘合剂通过表面暴露的疏水域与粘合基团介导界面相互作用,并借助内在无序的蛋白质结构维持凝聚网络,从而展现出强劲的湿态粘附力。然而,在常规蛋白质体系中复现这些特性仍面临挑战,尤其是在界面处稳定疏水残基及提升网络内聚力方面。本研究提出一种通用策略,开发出基于展开蛋白质的粘合剂:利用具有柔性长链和高电荷密度的聚电解质实现“锁定”。聚电解质与展开蛋白质之间显著增强的静电与氢键相互作用,使其既能稳定展开蛋白质暴露的疏水残基,又能通过链缠结增强网络内聚力。这种聚电解质-锁定的分子工程策略为设计具有优异湿粘附性能的蛋白质基粘合剂提供了通用框架。
2025年12月22日,该研究成果以“A Universal Polyelectrolyte-Locking Strategy: From Common Proteins to Stable Unfolded Protein-Based Adhesives for Rapid and Robust Tissue Sealing”为题发表在Advanced Materials(Adv. Mater.,DOI:10.1002/adma.202511921)。浙江大学毛峥伟教授和余丽莎研究员是论文的通讯作者。
大多普通蛋白质同时包含疏水残基和粘附功能基团(如极性/带电氨基酸),但在天然折叠状态下,疏水残基始终嵌入紧凑的三级结构中,有序的二级结构则限制了链的流动性。先前研究表明,化学变性剂(如三(2-羧乙基)膦、三氟乙醇、尿素)可通过蛋白质展开暂时暴露疏水域和粘附基团。然而,这些小分子在水中会快速扩散,进而引发蛋白质疏水坍塌和聚集,最终破坏界面疏水性维持机制(图1A,B)。因此,普通蛋白质要模拟海洋蛋白质粘合剂面临两大关键挑战:1)稳定暴露疏水残基以实现持久的排界面液体作用;2)展开蛋白质有效链缠结以实现能量耗散。
在本研究中,毛峥伟教授课题组开发了一种通用的聚电解质-锁定策略,利用高电荷且柔性的聚电解质锁定展开蛋白质暂时暴露的疏水残基。还原天然蛋白质中的二硫键会产生亚稳态展开构象,使疏水残基和粘附性官能团暴露于表面(图1A)。聚电解质借助分子间相互作用(如静电作用、氢键)稳定其展开状态,实现双重“锁定”:(i)维持表面疏水性;(ii)实现展开蛋白链有效缠结(图1C)。所构建的粘合剂能实现快速抗界面液体密封:表面疏水基团通过界面疏水性排界面血液或体液,使粘合基团与组织表面形成稳定粘附;而聚电解质锁定的展开蛋白链缠结则增强了内聚性能(图1D)。

图1. 稳定的展开蛋白基粘合剂设计。
本研究首先选用了牛血清白蛋白(BSA)和聚丙烯酸(PAA)分别作为模型蛋白质和聚电解质构建代表性组织粘合剂(UBSA-PAA)。分子动力学模拟结果初步证明了:聚电解质通过静电作用、氢键作用以及对疏水坍塌的熵限制,稳定了亚稳态展开蛋白质疏水残基的暴露,从而为聚电解质-锁定的展开蛋白质粘合剂建立了机制基础(图2)。

图2. 通过分子动力学(MD)模拟构建稳定的展开蛋白基粘合剂。
接着,本研究设计并制备了稳定的展开蛋白基粘合剂UBSA-PAA(图3)。展开蛋白质(UBSA)和PAA间具有显著增强的结合亲和力,其结合亲和力常数比原始蛋白质(BSA)和PAA之间的高出近两个数量级(1.05×108 M-1 vs. 1.51×106 M-1)。基于此所构建的稳定展开蛋白基粘合剂实现了卓越的表面疏水性(水接触角>90°)与内聚强度。优化后的UBSA-PAA粘合剂对新鲜大鼠器官(包括心脏、脾脏、肺和肾脏)表现出强劲的粘附力,并在湿猪皮上的搭接剪切(剪切强度:63.07 ± 6.52 kPa)、T型剥离粘附(界面韧性:86.07 ± 24.68 J m?2)及拉伸粘附测试(拉伸强度:104.50 ± 3.65 kPa))中均展现出优异的粘附性能,是商业纤维蛋白胶的3倍以上(图4)。以上结果充分说明了聚电解质-锁定策略的优势。
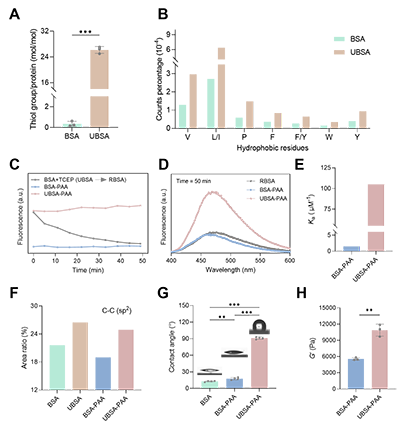
图3. 稳定的展开蛋白基粘合剂的设计与制备。

图4. 粘附性能
此外,本研究系统性地评估了UBSA-PAA体系之外的多种蛋白质-聚电解质组合,验证了聚电解质-锁定策略的普适性。所有展开蛋白基粘合剂均展现出优于对应原始蛋白质-聚电解质组的表面疏水性、内聚强度及粘附性能(图5)。

图5. 聚电解质-锁定设计策略的普适性
通过大鼠皮下植入模型研究了UBSA-PAA粘合剂体内生物降解性和生物相容性(图6)。UBSA-PAA植入物呈现渐进性质量损失,植入8周后几乎完全降解。组织学评估显示轻度炎症反应,与商用纤维蛋白胶观察到的异物反应相似。CD68与CD的定量免疫荧光分析显示,UBSA-PAA组与纤维蛋白胶组的表达水平相当。这些综合评估证实,UBSA-PAA粘合剂兼具可降解特性与优良相容性,满足临床粘合剂应用的核心标准。止血性能通过在两种肝脏出血模型(失血量减少92–95%,止血时间<10秒,图7)和一种严重股动脉出血模型(失血量减少88%,止血时间<50秒)中得到验证:与市售纤维蛋白胶相比,UBSA-PAA表现出抗血液冲刷、快速且牢固的密封能力。

图6. 生物相容性与生物降解性

图7. 大鼠肝脏出血模型的体内止血封堵
本研究致力于解决蛋白质基粘合剂设计中的一个关键挑战:通过聚电解质锁定展开蛋白质以稳定其暂时暴露的疏水残基,同时提升材料的本体内聚性能。以往研究虽利用蛋白质变性暂时暴露疏水区域,但由于缺乏有效的稳定机制,其在湿态环境中的应用受到限制。聚电解质-锁定策略通过将展开蛋白与聚电解质协同结合克服了这一局限。二者之间优化的静电相互作用与氢键实现了双重功能:在生物界面处稳定疏水残基,并通过链缠结增强内聚力。该方法的普适性源于其基本设计原则:(i)聚电解质链的柔性及电荷密度与展开蛋白的结构特征相匹配;(ii)界面疏水性与本体内聚性能协同结合,从而既能抵抗界面液体干扰,又能防止材料本体失效。本研究通过证明合适的聚电解质可将亚稳态展开蛋白质转化为功能性生物材料,为设计类海洋蛋白基粘合剂建立了一个可推广的通用框架。
该研究得到了国家自然科学基金、浙江省重点研发计划和浙江省中央指导地方科技发展专项资金的资助。
论文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202511921
- 浙大郑强/太原理工朱凤博团队 Macromolecules:盐掺杂聚电解质水凝胶在热刺激下的非平衡响应行为 2025-12-11
- 华南理工大学孔宪教授 Macromolecules:通过构建聚电解质电荷序列调控双电层电容器性能 2025-07-21
- 华工朱伟/中南林科大林亲录 AM:双重改性益生菌解锁“超级细胞工厂”“特洛伊木马” 之力-精准调节肠道菌群助力攻克溃疡性结肠炎 2025-06-09
- 福州大学吕晓林/吴明懋 Adv. Mater.:超分子复合水凝胶锁定阴离子提高锌离子电池循环寿命 2025-04-21
- 北大杨槐/北科大胡威团队 Small: 液晶弹性体中分子开关异构化行为的动态编程锁定 2025-03-14
- 宁波材料所茅东升/陈海明团队 Mater. Horiz.: 微相锁定自增强离子弹性体 2024-10-31
- 西安交大郭保林教授团队 Nat. Commun.:超快速自凝自膨胀自推进高粘附促凝止血粉末 - 开创不可按压出血止血救治新模式 2026-02-19
