植入式深脑探针(DBPs)是脑机接口的核心组件,但其面临两大瓶颈:传统刚性材料(如硅、金属)与脑组织模量失配引发免疫排斥,而柔性水凝胶材料因加工工艺限制难以实现多模态功能集成。如何开发兼具力学相容性与多功能性的新型探针,成为破解神经退行性疾病治疗难题的关键。
近日,四川大学与新加坡国立大学团队开发了一种水凝胶基多功能复合探针(HybF),通过湿纺工艺与离子螯合/解螯合技术,将导电、导光和药物递送纤维模块集成于PLGA基绝缘壳层中,实现了大鼠深部脑区的精准干预。相关成果以“Hydrogel-Based Multifunctional Deep Brain Probe for Neural Sensing, Manipulation, and Therapy”为题发表于ACS Nano(DOI: 10.1021/acsnano.5c03865)。
1.自适应力学性能的水凝胶纤维设计。HybF采用海藻酸钠/MXene导电水凝胶芯层与PLGA/MgO绝缘外壳的复合结构,基于多糖和MXene材料的超强亲水性实现HybF的干湿态刚度切换:干燥态下HybF的弯曲刚度约1 N/m,满足植入时的机械支撑需求,湿润态下HybF的弯曲刚度降至0.3 N/m(图1d),PLGA壳层的kPa级力学模量(图1e)也与脑组织模量相接近(0.1–1 kPa);上述设计解决了传统深脑探针“植入刚性不足”与“长期植入力学失配”的矛盾。
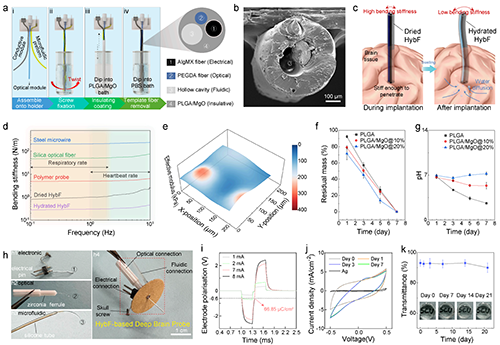
图1.多功能HybF的设计、制造和表征。
2.HybF导电、导光、导药的多模态功能集成及抗癫痫治疗的体内验证。高分辨电信号记录:MXene通过多重氢键相互作用与基质海藻酸钠纤维结合搭建三维导电网络,导电纤维模块阻抗低至97 S/m(1 kHz),可捕捉单个神经元动作电位(图2j);光遗传学调控:PEGDA水凝胶光纤模块透光率超90%(400–900 nm),635 nm光照通过HybF成功诱导hSyn-ChrimsonR转基因大鼠海马神经元放电(图2i),主成分分析(PCA)清晰区分光刺激前后的放电模式(图2k),同时重复光照可诱导癫痫样放电,验证了HybF的神经调控精度(图2l);时空可控药物递送: 在KA诱导的慢性癫痫大鼠模型中,中空纤维模块实现5-氨基酮戊酸(5-ALA)的局部释放,联合635 nm光照触发光动力效应,在癫痫大鼠模型中使异常放电幅值降低83%(图3i),同时治疗区域仅限光照靶点,未观察到邻近脑组织损伤,水迷宫实验显示HybF基光动力疗法后大鼠认知功能保留率超90%(图4a,b)。
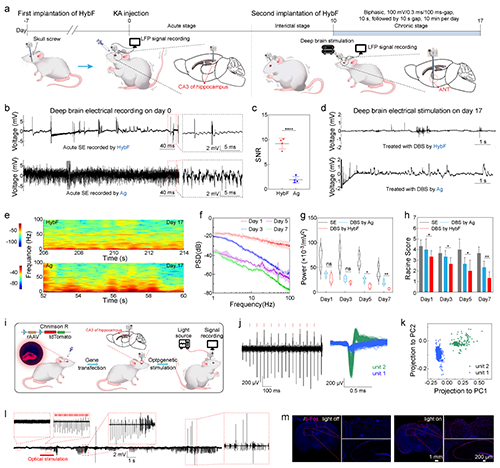
图2. HybF介导的深部脑刺激的功能验证。(深脑电刺激与深脑光刺激)
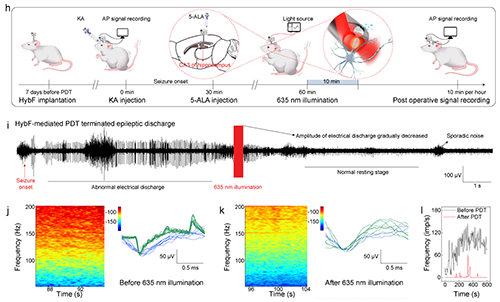
图3. HybF介导的深部脑记录和光动力疗法治疗癫痫。
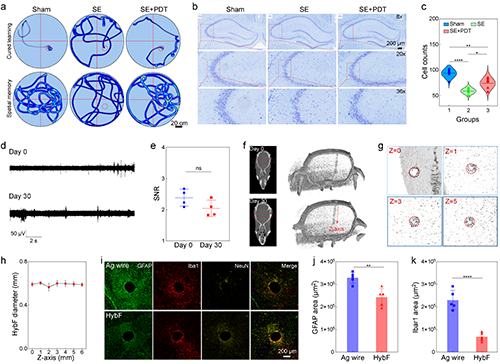
图4. HybF植入后的术后效果和生物相容性评价。
该研究首次实现水凝胶基深脑探针在深部脑干预中的多模态应用,其核心优势包括:基于海藻酸/MXene/PLGA的全降解体系,兼具力学匹配与功能集成;湿纺工艺支持规模化生产,HybF直径(约500 μm)适配现有植入器械;有望为癫痫、帕金森病等疾病提供临床“诊断-治疗-监测”一体化方案。
文章第一作者为四川大学博士研究生陈志鸿,通讯作者为新加坡国立大学Chwee Teck Lim教授与四川大学范红松教授。该研究获国家自然科学基金(32361133548, 52303195)、四川省科技厅项目(2024NSFSC1014)资助。
原文链接:https://doi.org/10.1021/acsnano.5c03865
- 浙大郑强/太原理工朱凤博团队 CEJ:碱激发粉煤灰催化的强韧复合水凝胶的可持续与规模化制备及其应用 2026-02-28
- UCLA 贺曦敏教授团队 Adv. Mater.:从“链段运动”入手 - 一种刷新各向同性纪录的超强韧PVA水凝胶 2026-02-26
- 宁波大学赵传壮 Macromolecules: 受挫相分离驱动的磷光可塑性水凝胶 2026-02-24
- 郑州大学姚伟睛/魏从/刘旭影 AFM:基于光热触发自修复聚氨酯弹性体的多功能热致变色荧光装置 2026-02-28
- 济南大学王鹏/河北工大王海行/济南大学阚皞/山大李阳 AFM:基于水控设计的高稳定性应力可调多功能传感凝胶纤维 2026-02-22
- 浙大杨栩旭研究员、李铁风教授/复旦梅时良研究员 AFM:喷涂实现的多功能水凝胶适形皮肤 2026-01-28
