近红外(NIR)响应药物递送系统利用NIR激光触发受控药物释放,并表现出高靶向能力、可调节的药物释放、高效的药物利用和低毒性。由于组织穿透深度和靶向能力的不足,一些光敏剂的光热转换效率受到阻碍。贵金属纳米结构表现出强表面等离子体共振、优异的光热转换能力、良好的生物相容性和低副作用,因此是提高光热转换效率以促进伤口愈合的潜在光敏剂。
日前,湖南大学的蔡仁教授团队设计了一种多功能Pd@Au Nanoframe水凝胶来检测尿酸(UA),用于原位监测伤口感染,并通过化学-光热策略促进伤口愈合。在加载抗菌莫匹罗星(M)后,所获得的M Pd@Au Nanoframe水凝胶显示出超过90%的莫匹罗星的最大累积释放速率,由NIR激光照射控制。在体外抗菌实验中,M Pd@Au Nanoframe水凝胶表现出NIR激光驱动的抗菌能力:98%的大肠杆菌在10分钟内被有效杀死。用M Pd@Au Nanoframe水凝胶的UA传感贴片涂覆兔伤口后,可以通过检测UA浓度实时监测伤口状态,从而通过化学-光热策略的新协同效应在4天内快速愈合伤口。这种方法成功地证实了一种闭环策略,即实时监测伤口的状态并有效地进行化学-光热伤口治疗,通过结合功能性水凝胶、NIR激光照射和药物抗菌剂来促进伤口愈合。相关工作以“Pd@Au Nanoframe Hydrogels for Closed-Loop Wound Therapy”发表在《ACS Nano》。该工作得到湖南大学谭蔚泓院士,陈卓教授,胡跃强教授的指导和支持。
【Pd@Au Nanoframe的制备与表征】
如图1所示,TEM 图像显示了异质结构的形成,即在六方纳米框架的表面形成了许多纳米颗粒。纳米框架和纳米颗粒的尺寸分别约为50和4 nm。高倍率TEM图像清楚地显示孔的尺寸分布在0.2-3 nm的范围内。通过所选区域电子衍射图样观察到多晶特征,这与XRD图样的结果一致。所有峰都可以归类为Pd(JCPDS:23–0345)和Au(JCPDS:04–0784)的晶相。同时,0.225和0.235 nm的晶格条纹分别对应于Pd的(111)平面和Au的(111)平面的d间距。TEM元素映射图像证实了Au和Pd元素的分布。在本报告中,异质结构被称为Pd@Au Nanoframe。
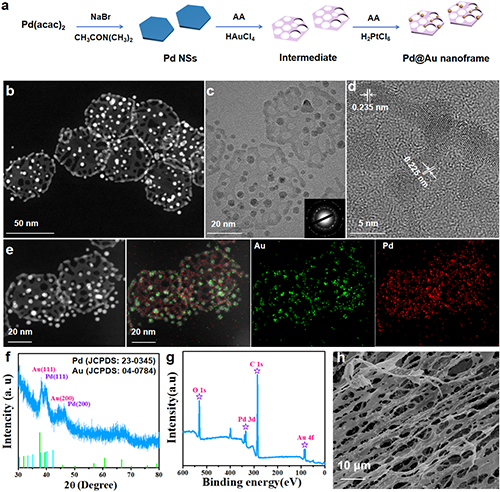
图1. Pd@Au Nanoframe:(a) 合成过程。(b-c) 透射电镜图像;(d) 高分辨率透射电镜图像;(e) 元素映射。(f) XRD图谱。(g) XPS光谱。(h) Pd@Au Nanoframe水凝胶的扫描电镜图像。
【Pd@Au Nanoframe 水凝胶的光热性能及药物输送性能】
在808 nm近红外激光照射下(1 W/cm2)300s,溶液温度随着Pd@Au Nanoframe浓度的增加而升高。在红外热成像中,Pd@Au Nanoframe水凝胶溶液的颜色从0 s的深蓝色到300 s的红色变化,表明在808 nm NIR激光照射下温度升高非常快。经过5次NIR激光照射实验后,每个循环的最高温度没有观察到显着变化,证实了Pd@Au Nanoframe 水凝胶优异的光热稳定性。这些结果表明,Pd@Au Nanoframe 水凝胶具有优异的光热转换性能,可用作潜在的NIR光敏剂。如图2所示,计算溶胀率并绘制为溶胀曲线。在37 °C和25 °C下观察到的溶胀率分别为24.23%和23.35%,这证明了M Pd@AuNanoframe水凝胶的优异溶胀性能。随后,通过紫外-可见光谱法测试了M Pd@AuNanoframe水凝胶的莫匹罗星负载能力,并获得了标准的莫匹罗星负载曲线。同时,计算了莫匹罗星负载能力和吸光度之间的线性关系:A = 0.01245 + 0.04489C。在这里,对于 5 mg/mL 莫匹罗星和 10 mg/mL 的溶液,莫匹罗星负载量分别为 0.0534 和 0.0335。
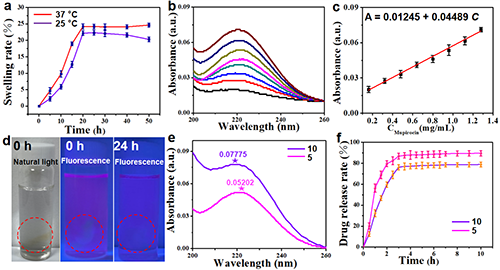
图2. (a) M Pd@Au Nanoframe水凝胶的溶胀性能。(b) 莫匹罗星溶液(0.16、0.32、0.48、0.64、0.8、0.96、1.12、1.28 mg/mL)的紫外-可见光谱。(c) 紫外-可见吸收与莫匹罗星浓度的关系。(d) 室温下用罗丹明B染色24小时的M Pd@Au Nanoframe水凝胶的照片。(e) 负载10 mg/mL(紫色线)和5 mg/mL(粉色线)莫匹罗星溶液的Pd@Au Nanoframe水凝胶的紫外-可见光谱。(f) 负载莫匹罗星的Pd@Au Nanoframe水凝胶的莫匹罗星释放曲线(10 mg/mL(紫色线)和5 mg/mL(粉色线))。
【体外抗菌性能及体内伤口愈合评价】
如图3所示,在对照样品和水凝胶组中,大肠杆菌表面光滑,大肠杆菌活力保持在98%以上,表明仅靠近红外激光照射不能杀死大肠杆菌。在Pd@AuNanoframe水凝胶组中,91%的大肠杆菌被杀死。对于M Pd@AuNanoframe水凝胶组,基于两个协同效应杀死了98%的大肠杆菌。这些结果表明,M Pd@AuNanoframe水凝胶表现出过氧化物酶样活性和出色的 NIR 激光响应性莫匹罗星递送,从而产生高效的协同抗菌活性。对于兔子伤口的治疗,Pd@Au Nanoframe水凝胶和M Pd@Au Nanoframe水凝胶之间的光热转换效率没有显着差异,证明了 Pd@Au Nanoframe作为优秀光敏剂的潜力(如图5所示)。

图3. (a) 体外酸性条件下的抗菌过程。(b) 大肠杆菌在琼脂平板上的菌落,分别经过与水凝胶、Pd@Au Nanoframe水凝胶以及M Pd@Au Nanoframe水凝胶孵育后,有或没有NIR激光照射。(c) 层状膜在808 nm NIR激光照射下(1 W/cm2,10 min)与水凝胶、Pd@Au Nanoframe水凝胶和M Pd@Au Nanoframe水凝胶孵育后的抗菌率。(d) 兔伤口处使用UA传感贴片的水凝胶、Pd@Au Nanoframe水凝胶和M Pd@Au Nanoframe水凝胶的红外热图像,在808 nm NIR激光照射下(1 W/cm2)。(e) 兔伤口处使用UA传感贴片的水凝胶、Pd@Au Nanoframe水凝胶和M Pd@Au Nanoframe水凝胶在NIR激光照射期间的温度变化。
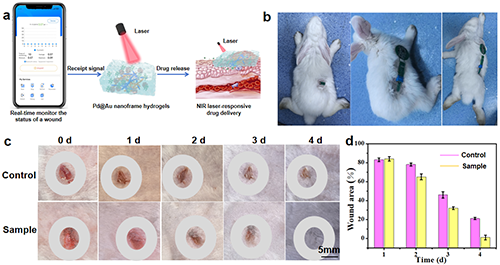
图4. M Pd@Au Nanoframe水凝胶的(a) NIR激光响应药物递送及智能手机读取测试结果。(b)佩戴M Pd@Au Nanoframe水凝胶UA传感贴片的兔子。(c) 第0、1、2、3和4天兔子伤口区域的照片。(d) 相对伤口面积。
总结:作者制备的M Pd@AuNanoframe水凝胶的UA传感贴片可以实时监测伤口状态,并通过对兔子进行化学-光热治疗的新协同效应在4天内加速伤口快速愈合。这种创新方法提供了一种闭环策略,即实时监测伤口状态和化学-光热伤口治疗,通过结合功能性水凝胶、光热效应和药物抗菌剂来促进伤口愈合。
- 兰州大学唐瑜、吕少瑜 Adv. Mater.:有机亚稳室温磷光水凝胶 2026-02-21
- 南京理工傅佳骏/姚博文团队 Nat. Commun.:类神经、导电通路可重构的水凝胶基一体化电子电路用于人-机整合 2026-02-14
- 华科大罗志强教授团队《Nat. Commun.》:可注射导电水凝胶实现无线、微创深部脑神经调控 2026-02-10
- 港中深唐本忠、赵征/深大熊玉 ACS Nano:细胞膜伪装的多重刺激响应型AIE纳米凝胶用于肿瘤的精准化学-光热协同治疗 2023-12-17
- 陕科大王学川/党旭岗、温州医科大郑漫辉 AFM:可注射自修复生物质基水凝胶生物粘合剂用于伤口愈合和可穿戴生物电子一体化 2026-01-30
- 西安交大郭保林教授团队 Adv. Mater.:自适应伤口敷料用于伤口愈合与修复 2025-12-25
- 西南大学Kang En-Tang/徐立群/鲁志松 AFM:伤口渗出液响应和促感染性伤口愈合的多层纤维敷料 2025-08-16
