前期研究表明,肿瘤放射治疗会通过诱导肿瘤细胞释放DNA片段来激活cGAS-STING信号通路启动抗肿瘤免疫应答,是放疗的远隔效应的诱因之一。然后,考虑到负电性的DNA片段的入胞效率低下,开发具有能够主动捕获放疗中肿瘤细胞释放的DNA片段并促进其入胞效果,有效通过提升放疗激活cGAS-STING信号通路的能力来实现高效的放射免疫协同治疗。
有鉴于此,苏州大学冯良珠教授和刘庄教授团队最新研究结果表明,利用壳聚糖分子与锰离子之间的配位做合成了具有在复杂生理条件下选择性捕获DNA能力的锰-壳聚糖(CS-Mn)微粒,用于提高放射治疗激活cGAS-STING的能力。体外实验结果显示,在水溶液中具有良好稳定的CS-Mn微粒一旦加入生理溶液中则快速解离释放线性壳聚糖分子,后者利用与DNA分子之间强烈的静电相互可以在血清等复杂生理溶液中形成带正电的DNA-CS配合物,进而显著增强DNA分子的入胞效率,并与Mn2+协同激活树突状细胞中的cGAS-STING通路并提升其抗原交叉呈递能力。将其注射到肿瘤内后,CS-Mn微粒协同局部放疗释放的DNA激活瘤内cGAS-STING细胞通路,显著提高瘤内CD8+T细胞和前体耗竭型TCF-1+PD-1+CD8+T细胞,显著提高对不同肿瘤模型中原发瘤(射线照射)和远端瘤(未照射)的抑制效果,与anti-PD-1免疫检查点阻断疗法联合后还能抑制肿瘤全身转移(图1)。这项工作报道了一种在复杂生理条件下具有高选择性捕获DNA片段能力的特洛伊木马样锰-壳聚糖微粒用于增效放射免疫联合治疗研究。相关工作以“DNA-Capturing Manganese-Coordinated Chitosan Microparticles Potentiate Radiotherapy via Activating the cGAS-STING Pathway and Maintaining Tumor-Infiltrating CD8+ T-Cell Stemness”为题发表在Advanced Materials上。文章的第一作者为苏州大学功能纳米与软物质研究院的硕士研究生张帅,通讯作者为冯良珠教授和刘庄教授。
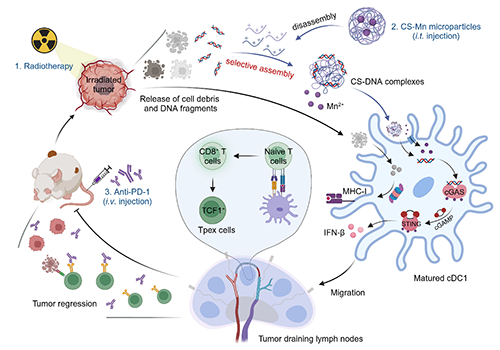
图1. DNA捕获型特洛伊样CS-Mn微粒增效放射免疫治疗原理的示意图
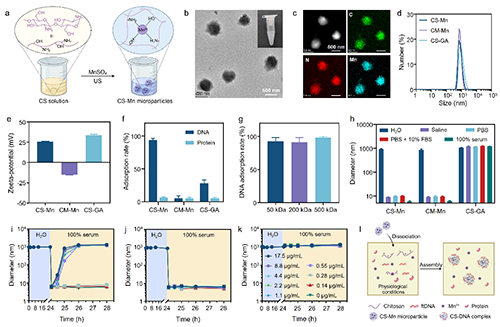
图2. CS-Mn微粒的合成与表征
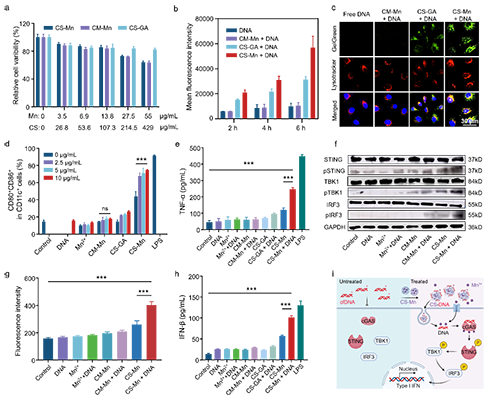
图3. CS-Mn微粒体外激活cGAS-STING通路
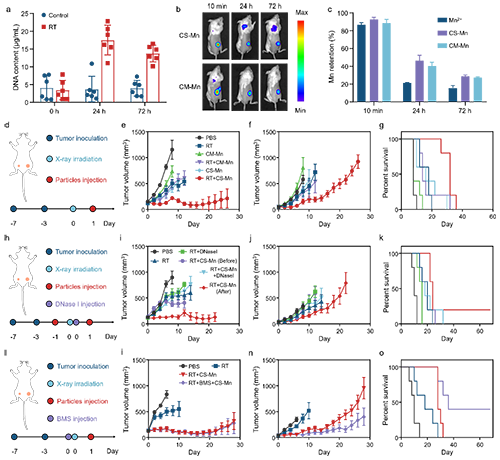
图4. CS-Mn微粒增敏放射治疗

图5. CS-Mn微粒与放射治疗协同启动抗肿瘤免疫
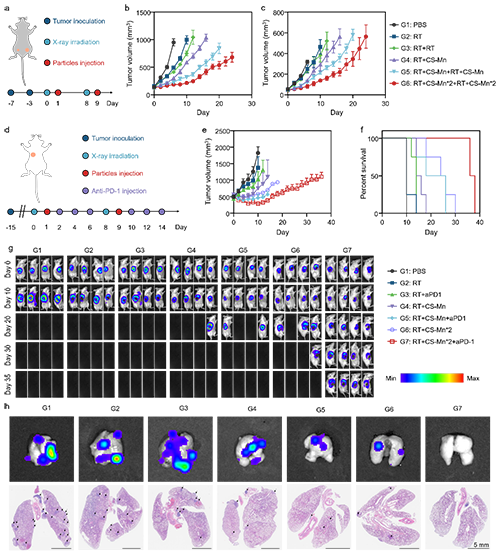
图6. CS-Mn微粒增敏分割放疗和放射免疫治疗
原文链接:https://doi.org/10.1002/adma.202418583
