刺激响应性水凝胶是一种含有大量水的三维智能材料,可对不同的外界刺激做出响应。典型的聚合物水凝胶可以以低成本设计并应用于多种刺激。然而,这些聚合物水凝胶缺乏特异性,对特定生物刺激或生物分子的感知能力较差。使用蛋白质、多肽、适配体等生物分子制备新兴刺激响应性水凝胶是解决上述问题的有效策略。

图1 刺激响应性蛋白质/多肽基水凝胶的构建单元及由其构建的传感器。
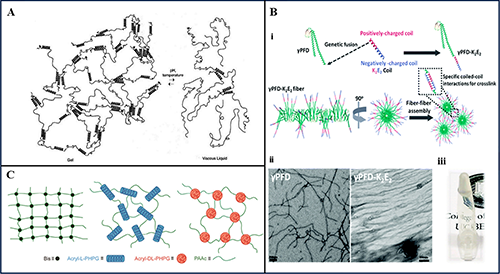
图2 (A) 卷曲螺旋肽自组装形成动态水凝胶的示意图。(B) (i) γPFD-K2E2水凝胶自组装示意图。预折叠蛋白的C端用带负电 (E-coil) 肽和带正电 (K-coil) 肽的交替片段进行修饰。(ii) 用K2E2卷曲修饰的γPFD 和γPFD 的 TEM 图像。(iii) 倒置管中形成的预折叠蛋白水凝胶的照片。(C)丙烯酰化L-PHPG 和丙烯酰化DL-PHPG 交联的水凝胶网络示意图。

图3 (A) Fmoc-F/PAAm杂化双网络水凝胶的凝胶化过程示意图。(B) 由一系列新型超短胶原蛋白模拟三肽和非胶原蛋白水凝胶剂共组装而成的杂化水凝胶的设计。(C) PAH/Fmoc-FFpY 超分子水凝胶的示意图:(i) PAH和Fmoc-FFpY之间的静电相互作用,导致(ii) 通过Fmoc-FFpY和PAH溶液的简单混合制备PAH/Fmoc-FFpY水凝胶。(D) (i) AP对Fmoc-FFpY进行去磷酸化,生成胶凝剂Fmoc-FFY:示意图 (ii) Fmoc-FFY 纳米纤维(蓝色)由 NPs@AP 通过 Fmoc-FFpY 去磷酸化自组装而成,生成 (iii) 混合超分子水凝胶,该水凝胶随时间发生相分离。

图4 (A) 化合物1-4的化学结构以及可能的反应方案,展示了暴露于各种小分子时凝胶到溶胶的相变。(B) (i) 抗原抗体半互穿网络水凝胶暴露于游离抗原时膨胀的机制。(ii) 抗原抗体半互穿网络水凝胶的制备方法。(C) 与AKtm/DTT 交联的HPMA基水凝胶以及水凝胶在底物作用下的宏观运动。
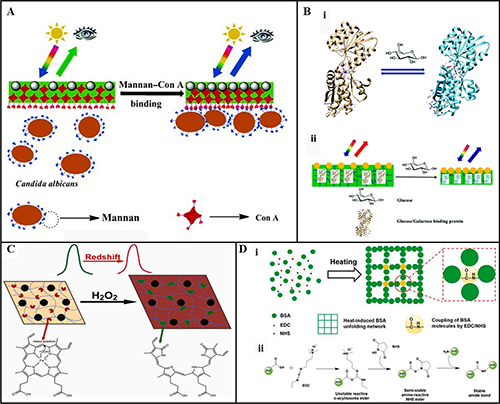
图5 (A) Con A-白色念珠菌表面甘露聚糖结合示意图。(B) (i)葡萄糖诱导的GGBP构象变化 (ii)葡萄糖结合诱导的2D PC GGBP水凝胶VPT引起衍射蓝移。(C) 2D PC HRP/BSA 蛋白复合水凝胶传感器选择性检测H2O2伴随红移。(D) (i)用于制作PNC-BSA水凝胶的单步蛋白质展开-化学偶联 (PNC) 方法;(ii) BSA 分子内羧基和氨基之间发生的EDC/NHS偶联反应。
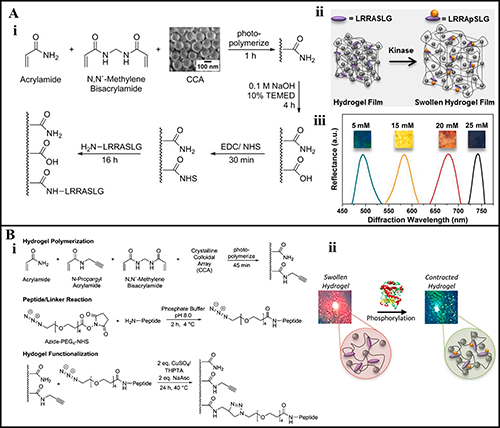
图6 (A) (i) 开发激酶响应CCA生物传感器。(ii) 使用肽底物 (LRRASLG) 对水凝胶进行功能化,该肽底物在暴露于蛋白激酶A (PKA) 时会膨胀。(iii) 随着固定的带负电基团浓度的增加(在pH=5.5时),观察到水凝胶封装的CCA的峰值光学反射率发生红移,同时水凝胶中的颜色发生变化。(B) (i) 利用点击化学对肽进行功能化,创建具有光学衍射特性的激酶响应水凝胶。(ii) 光学衍射水凝胶响应激酶磷酸化。由于肽功能化和磷酸化引起的晶格间距变化,水凝胶会发生可逆性溶胀和颜色变化。

图7 (A) PAAm/酪蛋白水凝胶示意图。(B) (i) LysMA 的合成途径和 (ii) 聚 (LysMA-co-AAm) 水凝胶的网络结构。(C) P(AAm/AMPS)-AFPS 水凝胶的制备示意图。(D) 具有各种可调性能的水凝胶示意图及其在可穿戴传感系统中的应用。
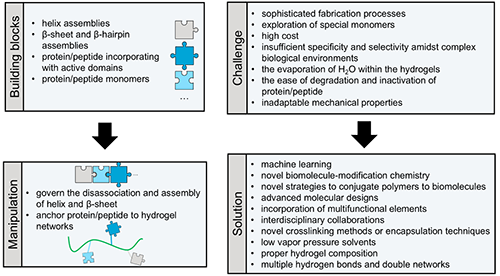
图8 刺激响应性蛋白质/多肽基水凝胶领域的总结与展望。
原文链接:https://doi.org/10.1016/j.pmatsci.2024.101355
- 浙江大学毛峥伟教授课题组Adv. Mater.:一种通用的聚电解质-锁定策略:从普通蛋白质到稳定的展开蛋白基粘合剂以实现快速稳健的组织密封 2025-12-25
- UCLA贺曦敏/燕山大学秦志辉、焦体峰 Adv. Mater.: 具有优异机械性能和耐久性的完全可降解蛋白质凝胶-氢键供体的调控 2025-06-27
- 华东理工刘润辉教授课题组 CCS Chem.:有效稳定蛋白质的伴侣样活性丝胶蛋白 2025-06-17
- 华东理工刘润辉教授课题组 Nat. Commun.:双胍化多肽模拟物抗多药耐药ESKAPE与脑膜炎 2025-12-12
- 东华大学史向阳教授 Nano Today:仿生金属-多酚网络包覆弹性蛋白样多肽胶束实现原位脑胶质瘤的声动力/化学动力/免疫治疗 2025-05-28
- 华东理工刘润辉教授课题组 AFM:功能化聚-β-多肽组装体抗耐药真菌感染 2025-05-09
- 南科大刘吉团队《Adv. Funct. Mater.》:刺激响应型水凝胶生物粘合剂用于构筑生物电子界面 2021-08-24
