蛋白多肽,是生物体内至关重要的组成部分,它在各种生命活动中起着至关重要的作用,具有抗衰老、抗氧化、抗过敏、抗微生物、抗血栓及促进细胞活性等营养和生物学功能。同时蛋白多肽还可以自组装成纳米粒子,参与到生物检测、药物递送、组织工程中,具有广阔的应用前景,因而受到科研界广泛关注。
从动物组织直接提取功能蛋白面临成分复杂、单体分离较难、提取工艺复杂、成本昂贵、批次质量不稳定、蛋白难以溶解(胶原蛋白在强酸下才能溶解)等难题,并且存在携带病毒、病原体等安全隐患。因此,通过构建绿色、高效的微生物细胞工厂定制特定功能的重组蛋白来替代动物提取势在必行。目前国内重组蛋白市场巨大,仅重组胶原蛋白市场规模在2022年就已增至185亿元。但多数生物活性蛋白如胶原蛋白需要形成稳定的超分子结构才能有着较好的生物活性,目前国内外主要以生产胶原蛋白片段为主,结构、活性完整的功能蛋白生产仍然是业内难题。
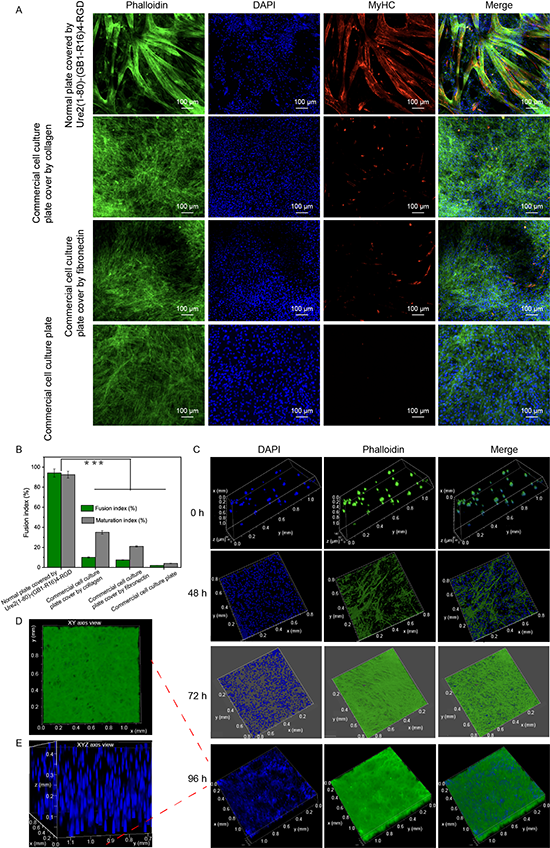
近日,江南大学生物工程学院吴俊俊教授课题组联合周景文教授、陈坚院士团队在国际权威期刊《Advanced Materials》(影响因子:29.400)上发表题为“A general and convenient peptide self-assembling mechanism for developing supramolecular versatile nanomaterials based on the biosynthetic hybrid amyloid-resilin protein”(DOI: 10.1002/adma.202304364)的学术论文。该研究通过将合成生物学与计算生物信息学、超分子化学、纳米技术进行多学科交叉融合,首次创造出的超强细胞修复蛋白——超分子弹性蛋白,效果优于目前所有商业化重组蛋白,这是目前唯一的一款同时具有大分子透明质酸、胶原蛋白、弹性蛋白、贻贝蛋白等诸多明星分子特性的新型功能蛋白。该蛋白同时具有活性位点外露的超分子结构(有利于蛋白活性的发挥)、强大保水特性、低分子量易吸收(保水特性好于目前的大分子透明质酸,仅仅1%的浓度即可形成水凝胶,但分子量小(几百万道尔顿 vs 几万道尔顿))、具备强效水下黏附特性(黏附效果优于贻贝蛋白,有利于蛋白持续发挥作用)、促进细胞粘附、增殖和分化、促进细胞损伤修复(修复效果优于目前的三型胶原蛋白和层粘黏蛋白)等优良特性,因而具有超强的细胞修复能力。
本论文主要解决了以下难题:
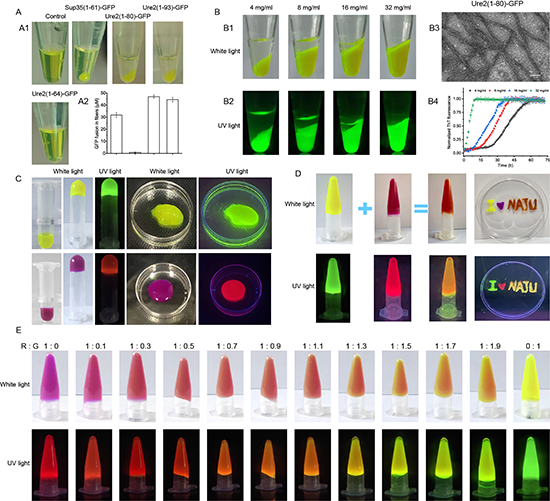
2.如何获得具有稳定超分子结构的功能蛋白一直为业界难题,当前多数功能蛋白如胶原蛋白或贻贝蛋白均需要通过酶学修饰获得理想结构,不仅存在着成本高、效率低等问题,上述共价修饰还易导致蛋白活性位点发生变化进而影响其功能;本研究发现将超分子自组装机制与弹性蛋白相结合,创造出的超分子弹性蛋白只需要通过静置即可获得稳定的超螺旋结构,并且本研究的超螺旋结构是由超分子力自组装而成,不仅不会改变蛋白活性,还会赋予超分子蛋白结构稳定以及活性提高等特性。

3.本文创造的超分子弹性蛋白有着独特的黏湿性特征,该蛋白遇水即粘,仅10mg的蛋白可粘附的起500g的砝码,在生物止血上有着重要应用前景。

4. 本文创造出的超分子弹性蛋白,同时具有大分子透明质酸、胶原蛋白、弹性蛋白、贻贝蛋白等各个明星分子的特性。这是目前唯一的一款同时具有强大持水特性、低分子量易吸收(持水特性好于目前的大分子透明质酸,但分子量小(几百万道尔顿 vs 几万道尔顿))、促进细胞粘附和活性、促进细胞损伤修复(效果好于目前的三型胶原蛋白和层粘黏蛋白)的新型弹性功能蛋白,具有极强的细胞修复特性。




原文链接:https://doi.org/10.1002/adma.202304364
本文第一/共同通讯作者吴俊俊教授简介:

吴俊俊,江南大学生物工程学院教授,博士生导师,加州大学伯克利分校访问学者(合作导师:合成生物学研究中心,美国工程院院士Jay Keasling),江南大学与华盛顿大学圣路易斯分校联合培养博士,师从陈坚院士。先后获得国家优秀青年基金、江苏省杰出青年基金、江苏省科协"青年科技人才托举工程"培养对象、江苏省“青蓝工程”优秀青年骨干教师等资助。担任南京市微生物学会理事,南京市食品中级职称委员会委员,国家自然科学基金通讯评审专家,Frontiers in Bioengineering and Biotechnology的评审编辑。主要从事通过整合交叉合成生物学、计算生物信息学、化学工程及材料学、纳米学等多学科,构建微生物资源分析工作站、天然产物/人造新功能蛋白设计-高通量筛选与制造-功能验证-规模化生产平台,聚焦新一代功能食品、功能蛋白材料及蛋白药物的大规模绿色生物智造核心技术。共主持国家级和省部级科研项目十余项,以第一作者/通讯作者身份在Advanced Materials、Nature communications、Metabolic Engineering等期刊发表多篇SCI论文。
- 陕科大王学川教授/党旭岗副教授 Small:盲鳗粘液启发的高拉伸自修复超分子水凝胶用于多功能自供电可穿戴设备 2025-01-20
- 中科大李闯教授 Adv. Mater.:基于CB[8]-螺吡喃主客体化学构建光响应超分子水凝胶 2024-08-28
- 林化所刘鹤研究员、武大陈朝吉教授 Nat. Commun.:纳米纤维素介导的多重动态协同作用构建按需粘附-分离型水凝胶电子皮肤 2024-05-10
- 华南理工大学边黎明、张琨雨、赵剑阳/广东省人民医院张余 Nat. Commun.:细胞自编程的非均质水凝胶通过力学-表观遗传调控促进组织再生 2026-02-04
- 东南大学张天柱教授团队《ACS Nano》:封装脂肪干细胞外泌体补片用于调节炎症和促进组织再生 2025-06-09
- 武汉轻工大学朱链/未本美、湖北工程学院汪海波 Polym. Rev.: 胶原生物材料的最新进展 - 从提取、交联到组织再生 2025-03-21
