过硫酸铵(APS)作为一种氧化剂,常在材料制备中用作化学催化剂,具有强的细胞毒性,南方医科大学第五附属医院邱小忠团队提出了一种“化毒物为药物”的材料生物学干预策略,同时采用APS作为纳米颗粒的化学催化剂和心肌梗死治疗药物,起到“一石二鸟”的作用。
心肌梗死(MI)是全球范围内死亡的主要原因,虽然在临床试验中已经采用将治疗性细胞移植到疤痕组织中进行心脏修复的策略,但是心梗区恶劣的微环境使移植的细胞难以存活,只能引起心功能微弱的提高。因此,通过功能性生物材料原位激活内源性细胞治疗心肌梗死是一种具有前景的治疗策略。心外膜细胞是一种多能性心脏祖细胞,在心脏发育和心脏重塑过程中起着重要的细胞来源作用。在心脏发育早期,心外膜细胞可以通过上皮-间充质转化(EMT),分化为平滑肌细胞、心脏成纤维细胞、内皮细胞、甚至可能分化为心肌细胞。而哺乳动物成年心外膜细胞在正常生理条件下通常是沉默状态,心梗后,它们可以重新启动胚胎期遗传程序,发生EMT分化成多种细胞,在一定程度上支持心脏修复,但是这不足以促进成人心脏的充分修复。目前,许多研究通过心梗死后注射细胞因子或调节非编码RNAs (ncRNAs)来增强内源性心外膜细胞EMT过程,进行心梗修复。然而,这些方法通常是复杂和昂贵的。此外,这些裸露的细胞因子或ncRNAs仍然面临半衰期短、容易失活和细胞摄取不足的挑战。


图1. (A) NPs/APS的制备及其在体外诱导WT1+心外膜细胞EMT的机制。(B) NPs/APS可以促进梗死区血管新生从而促进心梗修复。


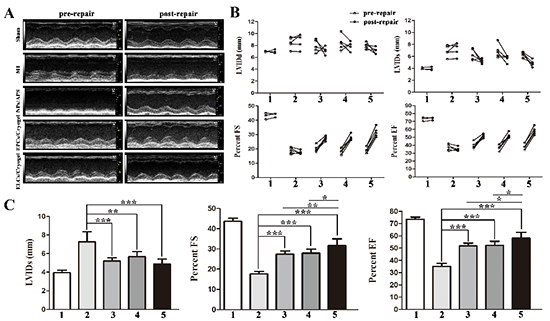
图4. NPs/APS注射到心梗区后可以促进心功能提高。1:假手术组,2:心梗组,3:NPs/APS注射组,4:EPCs/cryogel组,5:ELCs/cryogel组。
在本研究中通过NPs/APS纳米组装作为治疗药物,对心肌梗死表现出明显的修复作用。此外,团队还研究了NPs/APS诱导心外膜细胞EMT的机制,该机制与自噬和mTOR通路有关。诱导内源性心外膜细胞EMT是梗死区持续产生新生血管的有效方法,此研究为心梗修复提供了新的理论基础和材料储备。
论文链接:https://pubs.acs.org/doi/full/10.1021/acsnano.3c06229
