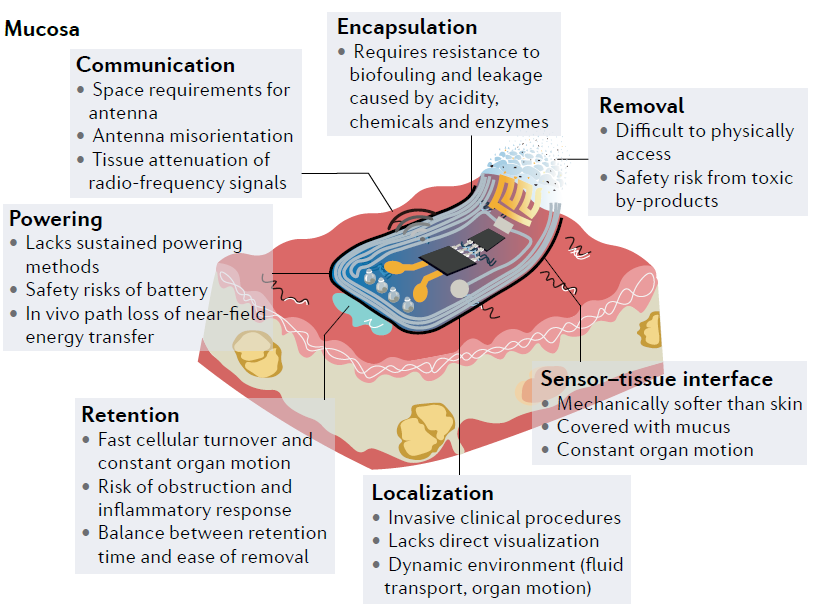
黏膜(mucosa)作为覆盖消化道、呼吸道、生殖道和泌尿道的重要器官组织,是人体内部与外界环境之间物质和能量交换的首要屏障。黏膜总面积约为皮肤面积的200倍,其携带的生理信息和疾病诊断价值远超后者。此外,黏膜还是人体口服药物的首要吸收器官,目前占到全人类用药总量的90%以上。然而,当前针对黏膜的无缝、长期稳定、安全的监测手段十分匮乏。
与之形成鲜明对比, 近年来电子皮肤(skin-interfacing electronics)或可穿戴电子(wearable electronics)等研究领域发展迅速。经过几个世纪、数以万计科研工作者的不懈努力,电子皮肤已经开始走出实验室,并逐渐具备了取代传统医疗监护设备进行连续、无创、居家式医疗检测的潜力。这方面杰出的例子包括美国西北大学John Rogers院士团队开发的针对早产儿脆弱皮肤设计的超柔性、无线电子皮肤贴片(已创办公司);和美国加州理工学院Wei Gao教授团队开发的可实时、无线监控人体汗液中各项生化指标的集成式柔性电化学传感器,并已临床应用于痛风、伤口愈合等疾病的监护。

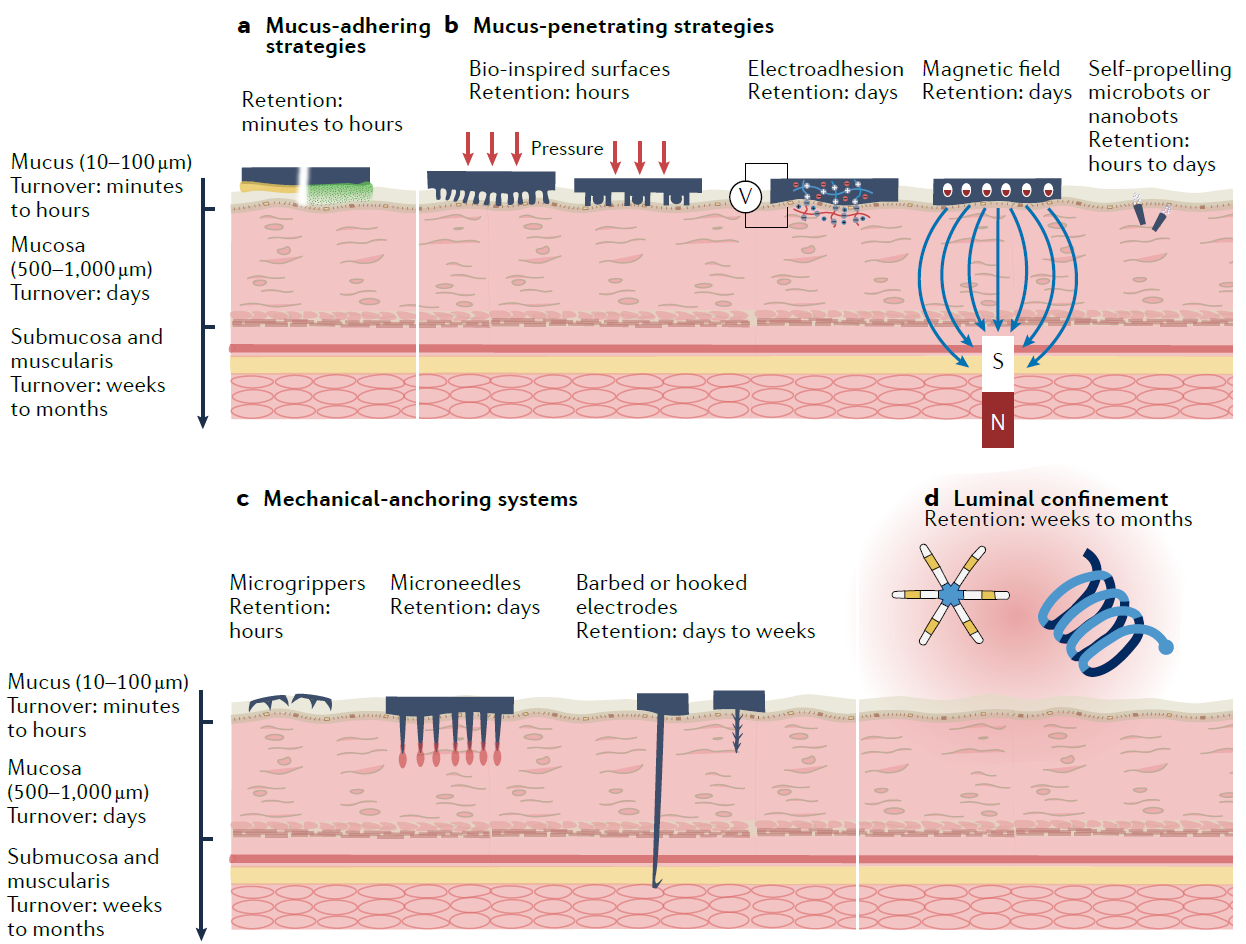
图1:电子黏膜(mucosa-interfacing electronics)的概念。

论文链接:https://doi.org/10.1038/s41578-022-00477-2
作者介绍:
南科望博士,2022年底将加入浙江大学药学院,任博士生导师,入选浙大“新百人计划”。2019年至今先后在美国哈佛大学生物工程系、麻省理工学院机械工程和哈佛医学院附属布莱根妇女医院从事研究工作,师从美国四院院士Robert S. Langer教授和Giovanni Traverso教授。2018年博士毕业于美国伊利诺伊大学香槟分校机械工程系,师从美国四院院士John A. Rogers教授。2014年本科毕业于美国莱斯大学材料工程系。主要研究方向包括柔性电子器件、类器官芯片、生物医疗传感器、智能电子药物等。相关工作以一作或通讯身份在Nature Materials、Nature Biomedical Engineering、Nature Reviews Materials、Science Advances等国际知名期刊发表,总被引超过2500次。课题组现招收博士后1-2名,2022年底开始,有意者请发邮件至:kewang.nan@gmail.com。
应斌斌博士,目前在麻省理工学院机械工程和哈佛医学院布莱根妇女医院Giovanni Traverso教授和Robert Langer教授联合课题组从事博士后研究。2020年于加拿大麦吉尔大学获得机械工程博士学位,并于2018年至2020年期间在多伦多大学机械系进行学术访问。目前主要研究方向为可食用电子, 软材料和软体机器人,及其在肠胃道中的生物医学应用。相关科研成果发表在电子、材料和机器人领域国际权威期刊和会议,其中包括Nature Reviews Materials, Advanced Functional Materials, Materials Horizons, Lab on a Chip和IEEE International Conference on Robotics and Automation (ICRA)等。曾获得加拿大NSERC 博士后奖学金,国家优秀自费留学生奖学金, 2020 Materials Horizons 最杰出论文奖等。
- 海南大学张晖/杜杰教授团队 Adv. Sci.:年糕启发的纹理化Janus水凝胶-用于身体信号传感与人机交互的柔性电子皮肤新突破 2025-08-02
- 中国科大龚兴龙教授团队 AFM:天然皮肤启发的多功能柔韧皮革基电子皮肤 2025-05-27
- 西南林大杜官本院士、杨龙研究员团队 Nano lett.:面向水下电子皮肤的温控响应纤维素基 Janus 智能水凝胶 2025-05-09
- 芝加哥大学王思泓教授团队《Nat. Commun.》:超柔软可拉伸有机电子器件 2023-08-08
- 北京大学雷霆课题组博士后、科研助理及材料合成工程师招聘启事 - 有机高分子功能材料、有机电子学和生物电子学方向(长期有效) 2022-11-11
- 南方科技大学郭旭岗教授《Nat. Mater.》评论:导电聚合物从发现到应用的历程 2020-09-01
- 华科大罗志强教授团队《Nat. Commun.》:可注射导电水凝胶实现无线、微创深部脑神经调控 2026-02-10
