肿瘤细胞即使在氧气充足的情况下也会通过糖酵解方式来进行代谢,消耗大量葡萄糖并最终生成乳酸,这种现象被称为肿瘤的有氧糖酵解,也叫做Warburg效应。在这一过程中存在一个重要的限速酶,即M2型丙酮酸激酶(PKM2)。它在多种肿瘤细胞中高表达具有低活性的PKM2(二聚体),当通过激动剂将低活性的PKM2二聚体转变为高活性的四聚体后,有利于抑制糖酵解过程,阻断肿瘤细胞的增殖作用,被视为有效的肿瘤药物研发的新关注点。
国家纳米科学中心李莉莉研究员,与哈尔滨医科大学第四附属医院徐万海教授和宝鸡文理学院AIE研究中心冯海涛教授合作,共同开发了一种基于“可生物激活体内组装”纳米技术的糖肽自组装PKM2纳米激动剂(GPNA1)。通过PKM2上游的葡萄糖水解酶(OGA)的水解作用,促使GPNA1从纳米颗粒原位转变为纳米纤维结构,激活并有效提升PKM2活性。从高效促进PKM2四聚化和捕获PKM2减少核易位两方面同时作用,有效抑制肿瘤增殖,最终协同增敏化疗治疗。对于高转移的前列腺癌和三阴性乳腺癌,实现治疗增效和转移抑制。
本文要点:
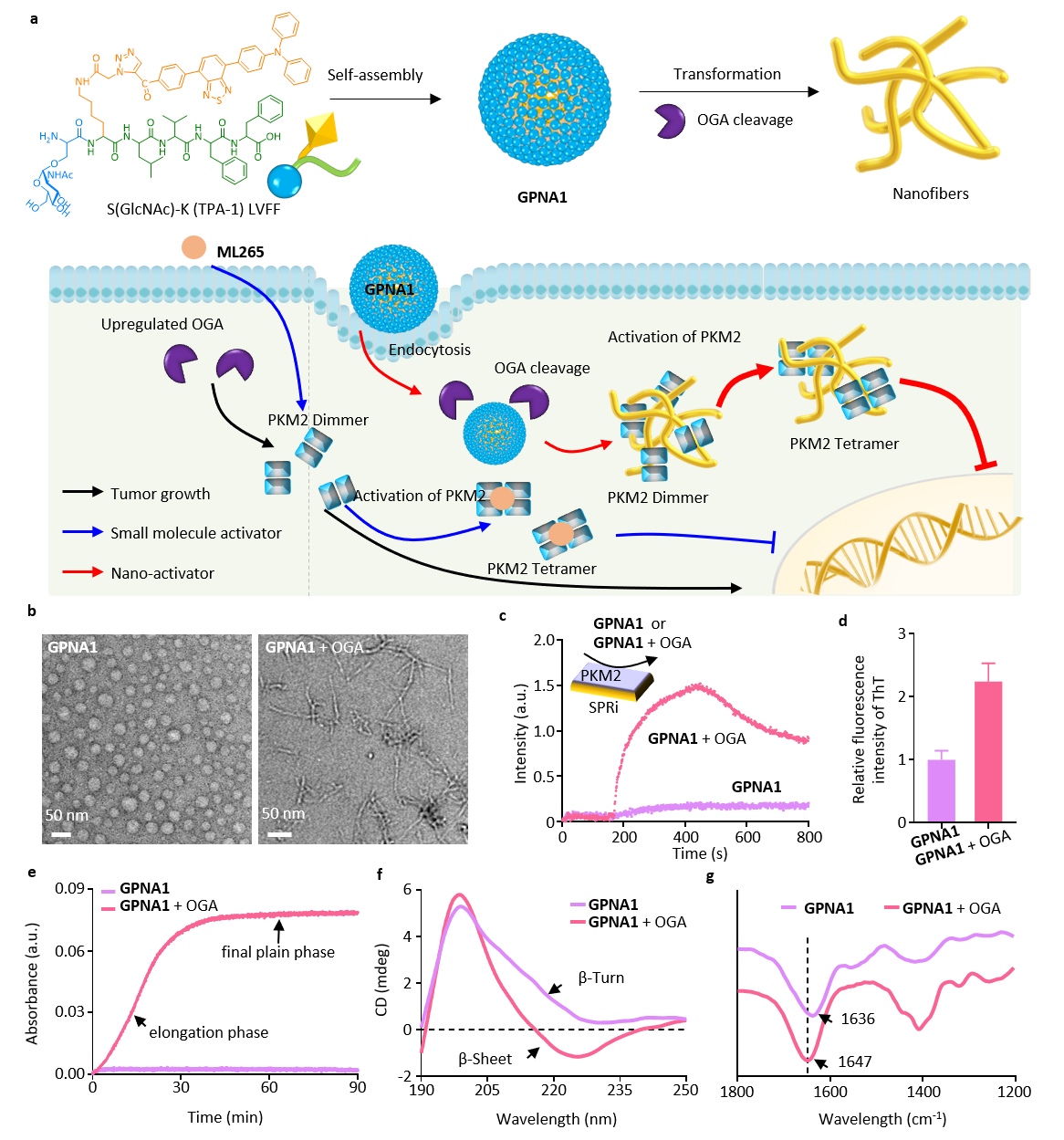
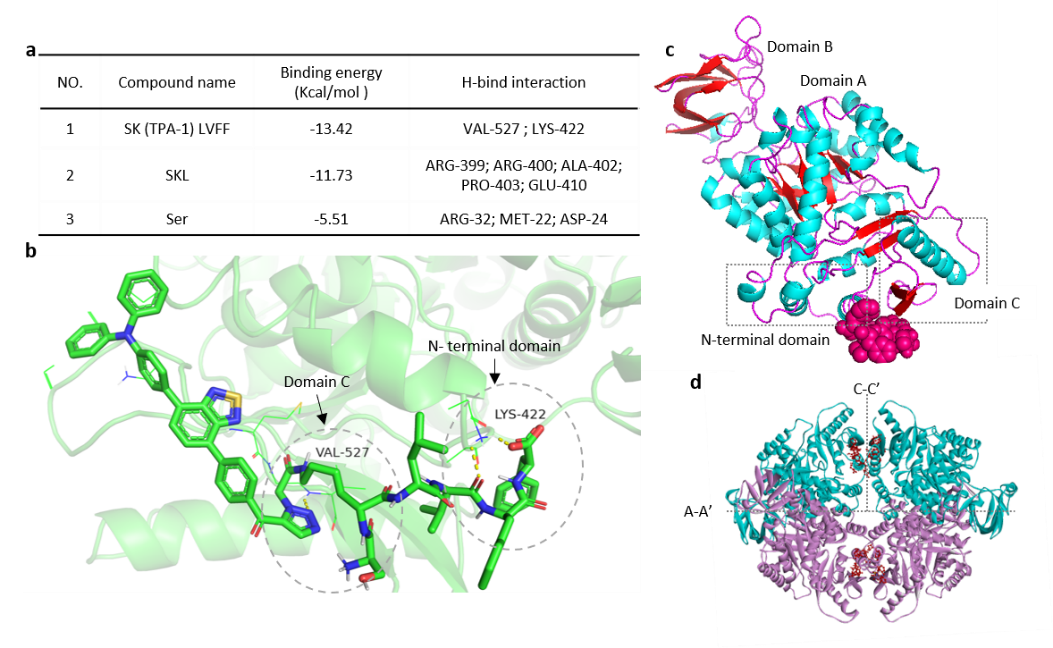
(1)实验设计的GPNA1能够在OGA酶水解剪切下激活与PKM2的结合,结合位点在PKM2的N端区和C区;同时,纳米颗粒到纳米纤维的变形,提升了与PKM2的结合稳定性,从而有效促进PKM2的四聚化。
(2)实验结果表明,GPNA1可以高量长效滞留在肿瘤细胞内,与肿瘤细胞内的OGA及PKM2良好的共定位,有效促进PKM2的四聚化,抑制PKM2转运至细胞核。
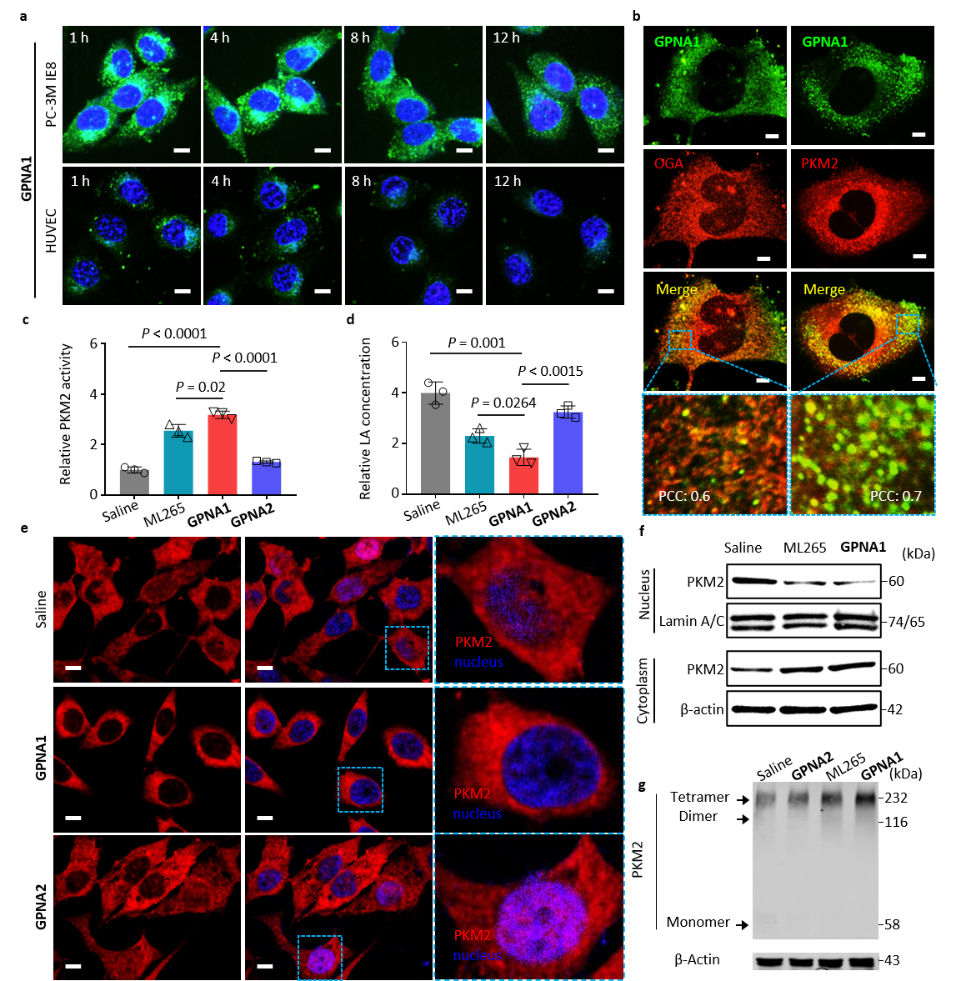
(3)GPNA1的活性表明:其PKM2激活的AC50为9.9 μM,肿瘤细胞的IC50为40.8 μM,与化疗药物多西他赛联合使用时,可将化疗药物的IC50降低4.3倍。通过纳米激动剂的被动靶向机制,有效富集到肿瘤区域,利用纳米纤维结构实现肿瘤区域内的长效富集和滞留,最终抑制肿瘤细胞有氧糖酵解,减少肿瘤细胞转移。
(4)在荷瘤小鼠肿瘤模型中的结果表明,与单一化疗(多西他赛或者阿霉素)治疗相比,通过GPNA1的有氧糖酵解抑制,有效协同增敏了化疗。对于高转移的前列腺癌和三阴性乳腺癌,均体现出高效肿瘤生长抑制、肿瘤肺转移抑制等活性,有效延长小鼠的生存期。
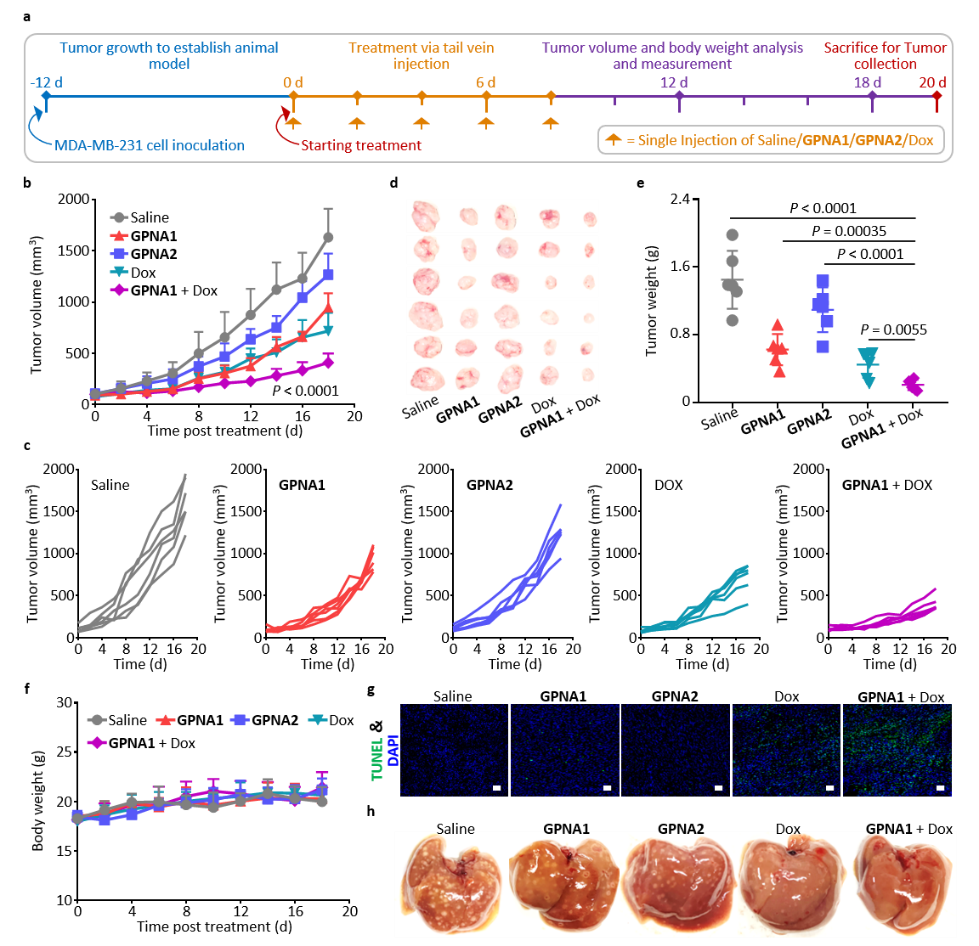
综上所述,这种新开发的基于“可生物激活体内组装”纳米技术的PKM2糖肽纳米激动剂,提出了高效阻断糖酵解的新策略,为高侵袭、高转移肿瘤的治疗以及化疗增敏提供解决方案。本工作由哈尔滨医科大学附属第四医院博士研究生侯大勇和王佳起,以及中国科学院理化研究所博士研究生肖五一为共同第一作者,国家纳米科学中心李莉莉研究员、哈尔滨医科大学第四附属医院徐万海教授和宝鸡文理学院AIE研究中心冯海涛教授为共同通讯作者,上述研究工作得到了国家自然科学基金、中科院前沿科学重点研究项目和国家自然科学基金区域重点项目的支持。
https://www.sciencedirect.com/science/article/abs/pii/S0142961222001624?via%3Dihub
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
