基于split protein (拆分蛋白)的分子工具被应用于生物信号的控制、高级生物分子结构的设计等,但是诸多缺点,包括自发重组的不可控性,产物的不稳定性以及缺乏动态多样性等限制了此类工具更广泛的应用。香港科技大学孙飞课题组近期成功拆分光敏转录调节因子CarHC, 获得一种新型的同时具有小分子(维生素B12)/光响应能力的蛋白质组装工具split CarHC。这一新手段也催生了一系列具有可调机械性能的光敏水凝胶的设计研发,可被应用于三维细胞培养及细胞—细胞外基质相互作用等研究。该工作以“B12-induced reassembly of split photoreceptor protein enables photoresponsive hydrogels with tunable mechanics” 为题发表于《Science Advances》杂志(2022.04.)。文章第一作者是香港科技大学杨中光博士,通讯作者为香港科技大学孙飞教授。
光敏蛋白CarH最早作为合成类胡萝卜素基因的转录调节因子在细菌中被发现。其C端结构域CarHC在黑暗中与腺苷钴胺(AdoB12)结合后四聚,并在暴露于绿光或白光时重新解聚为单体(图1)。细菌细胞利用这一过程控制CarH与类葫芦卜素基因的结合程度从而操纵该基因的表达水平。CarHC的光敏和多聚特性促成了多种光遗传学工具及光敏水凝胶材料的研发。
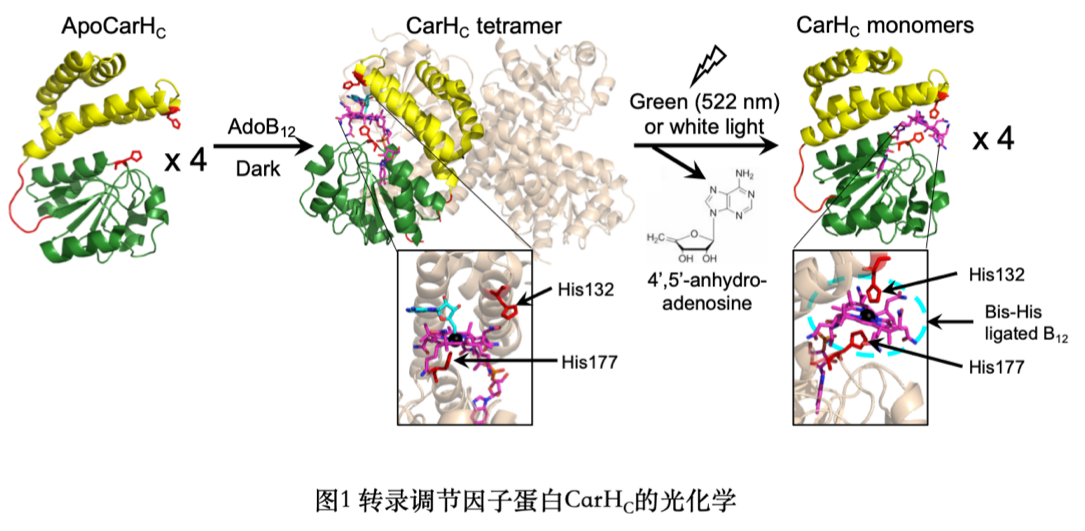
CarHC主要由一个四螺旋束(four helix bundle)结构域和一个B12结合结构域构成,二者之间通过一段无结构的多肽序列连接(图2)。该工作将CarHC于此段无结构的区域切分,并在体外利用大肠杆菌成功表达、纯化两个重组蛋白,即CarHCN和CarHCC(split CarHC)(图2)。CarHCN和CarHCC在体外不会自发重组,当与AdoB12结合后会重组并四聚;在暴露于白光后四聚体解聚为单体CarHC。由于分别来源于CarHCN、CarHCC的两个组氨酸(His132和His177)和B12内钴离子形成的稳定结构,光解后的单体CarHC不会进一步解聚为CarHCN和CarHCC(图3)。与AdoB12不同,甲钴胺(MeB12)虽然也可以介导CarHCN与CarHCC的重组,但并不会引发四聚(图3)。split CarHC与AdoB12/MeB12反应的多样性及鲁棒性反映其在复杂生物体系内进行精准信号控制的潜能。


除此之外,基于split CarHC结合AdoB12/MeB12后所展现出的两种光响应蛋白化学(图3),以及自发形成共价键的Spy蛋白化学,该工作设计合成了两种光敏水凝胶材料——受光照后机械硬度降低的Ado胶和受光照后机械硬度增强的的Me胶 (图4)。两种水凝胶都被应用于三维培养人间充质干细胞(hMSCs)。鉴于与天然生物组织如骨髓(0.5-1.5千帕),脂肪(0.5-1.0千帕)和脑组织(0.1-1.0千帕)机械强度的相似性,这两种光敏水凝胶也许可以被应用于材料生物学和组织再生领域。

本文通过拆分细菌光感受蛋白CarH的 C 端结构域,开发出一种同时响应维生素B12/光的蛋白质组装分子工具,split CarHC。split CarHC具有极低背景重组,高稳定性,高特异性及光可控性等优点,可用于构建具有动态机械性能的光响应蛋白水凝胶,支持三维细胞培养。与此同时, split CarHC也有潜力成为一种新型控制体内生物信号传导的光遗传学工具。
原文链接:https://doi.org/10.1126/sciadv.abm5482
