糖尿病足溃烂是糖尿病引起的并发症之一,严重影响糖尿病患者的身心健康和生活质量,并增加了患者截肢的风险。过量的炎症因子和活性氧以及细胞功能的缺失是导致阻碍糖尿病伤口愈合的主要原因。一般来说,炎症过程出现在伤口愈合过程之前,是整个愈合过程的重要的一部分。但是,在糖尿病慢性伤口环境中,炎症过程被延长,导致成纤维细胞凋亡,氧化应激失调和活性氧过量。同时,人体自身的抗氧化系统不足以纠正这些由糖尿病引起的功能失调。现阶段,用于治疗糖尿病伤口修复的生物材料大部分依赖于其装载的药物、生长因子或生物活性分子。但是,这些药物、因子和生物分子价格昂贵,半衰期短,而且容易引起其他副作用。因此,亟需开发一种本征具有调节炎症和加速伤口愈合能力的生物材料。
针对这一问题,西南交通大学鲁雄教授、谢超鸣副教授团队和四川大学华西口腔医院王军教授团队联合开发了一种超长导电丝素纤维,并同时用于糖尿病伤口修复和生理信号监测(图1)。其中,导电丝素纤维通过仿贻贝聚多巴胺(PDA)保护-剥离策略制备得到。在丝素纤维剥离的碱性环境中,由于PDA可快速聚合在剥离的丝素纤维的表面,避免了丝素纤维结构被氢氧根过渡的破坏,使丝素纤维保持了超长的纤维结构(长度达700 μm)。同时,由于丝素纤维表面的PDA,使得导电高分子PEDOT可以均匀组装在纤维表面,得到仿贻贝导电丝素纤维。最后利用丝素蛋白作为基质,以仿贻贝导电丝素纤维为填料,制备得到了仿贻贝导电丝素纤维贴片。
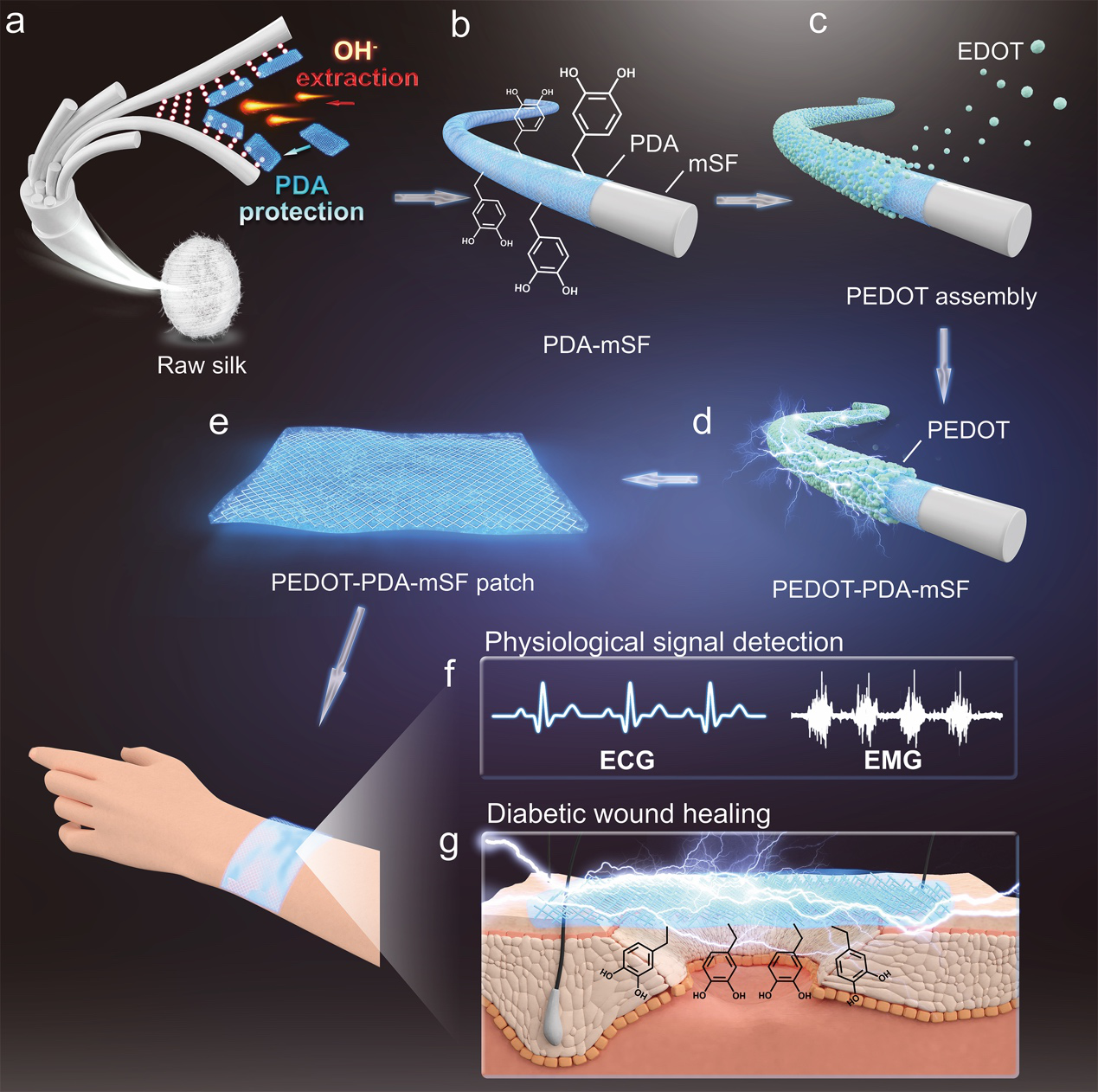
图1.导电丝素纤维制备过程示意图。(a)PDA保护-剥离丝素纤维过程。(b)PDA保护的丝素纤维(PDA-mSF)。(c)PEDOT自组装过程。(d)仿贻贝导电丝素纤维(PEDOT-PDA-mSF)。(e)PEDOT-PDA-mSF贴片。贴片可用于糖尿病病人(f)生理信号实时监测和(g)伤口修复。
该仿贻贝导电丝素纤维贴片能有效改善糖尿病伤口微环境,并加伤口愈合。首先,PDA赋予贴片细胞/组织亲和性和粘附性,能促进纤维细胞的粘附和迁移(图2-1)。其次,贴片的导电性为内源生理电信号的传输提供了通路,诱导细胞迁移和定向,并且促进了胶原的沉积和排列(图2-2)。第三,贴片通过PDA消除自由基的能力降低炎症因子IL-6和TNF-α的表达减轻了伤口的炎症反应,从而增加了成纤维细胞的活性,避免了其凋亡(图2-3)。最后,由于PDA消除自由基的能力,MMP-2和MMP-9的表达被降低,伤口微环境的氧化应激失调得到了有效控制,从而提高了成纤维细胞的活性,调节了胶原沉积和细胞外基质重建(图2-4)。导电丝素贴片多种优良性能协同地逆转了糖尿病伤口的微环境,最终导致肉芽组织再生和伤口愈合。不仅如此,由于良好的导电性,该贴片还可以作为柔性电极实时监测病人的生理信号,有望用于诊疗一体化生物电子。

图2. 仿贻贝导电丝素纤维贴片加速糖尿病伤口修复机理图。

图3. PEDOT-PDA-mSF的表征。(a-b)传统碱剥离后的丝素微纤维;(c-d)PDA保护-剥离后的丝素微纤维。粉红色伪色:PDA;(e-f)PEDOT自组装在纤维表面。绿色伪色:PEDOT;(g)PEDOT-PDA-mSF纤维的XPS谱图;(h)不同纤维表面的Zate电位;(i)不同纤维的表面的接触角。

图4. PEDOT-PDA-mSF纤维贴片的机械性能和导电性。(a)PEDOT-PDA-mSF纤维贴片内部结构的SEM图片;(b)PEDOT-PDA-mSF纤维贴片的柔韧性展示;(c)不同PEDOT-PDA-mSF纤维的贴片的循环拉伸曲线;(d)不同PEDOT-PDA-mSF纤维的贴片的拉伸强度;(e)PEDOT-PDA-mSF纤维贴片的导电性展示;(f)不同PEDOT-PDA-mSF纤维的贴片的导电性;(g)电刺激下,细胞在PEDOT-PDA-mSF纤维贴片上的荧光照片;(h)电刺激下,细胞在PEDOT-PDA-mSF纤维贴片上的长径比;(i)电刺激下,细胞在PEDOT-PDA-mSF纤维贴片上的活性;(j-k)PEDOT-PDA-mSF纤维贴片作为植入电极;(l-m)PEDOT-PDA-mSF纤维贴片作为表皮电极。

图5. PEDOT-PDA-mSF纤维贴片的抗氧化能力。(a)PEDOT-PDA-mSF纤维贴片的抗氧化机理;(b)PDA-mSF纤维贴片的CV曲线;(c)不同贴片与DPPH反应后的UV-vis曲线;(d)不同贴片消除ROS的效率;(e)不同贴片细胞内消除ROS的能力评价;(f)不同贴片细胞内消除ROS能力的定量对比。
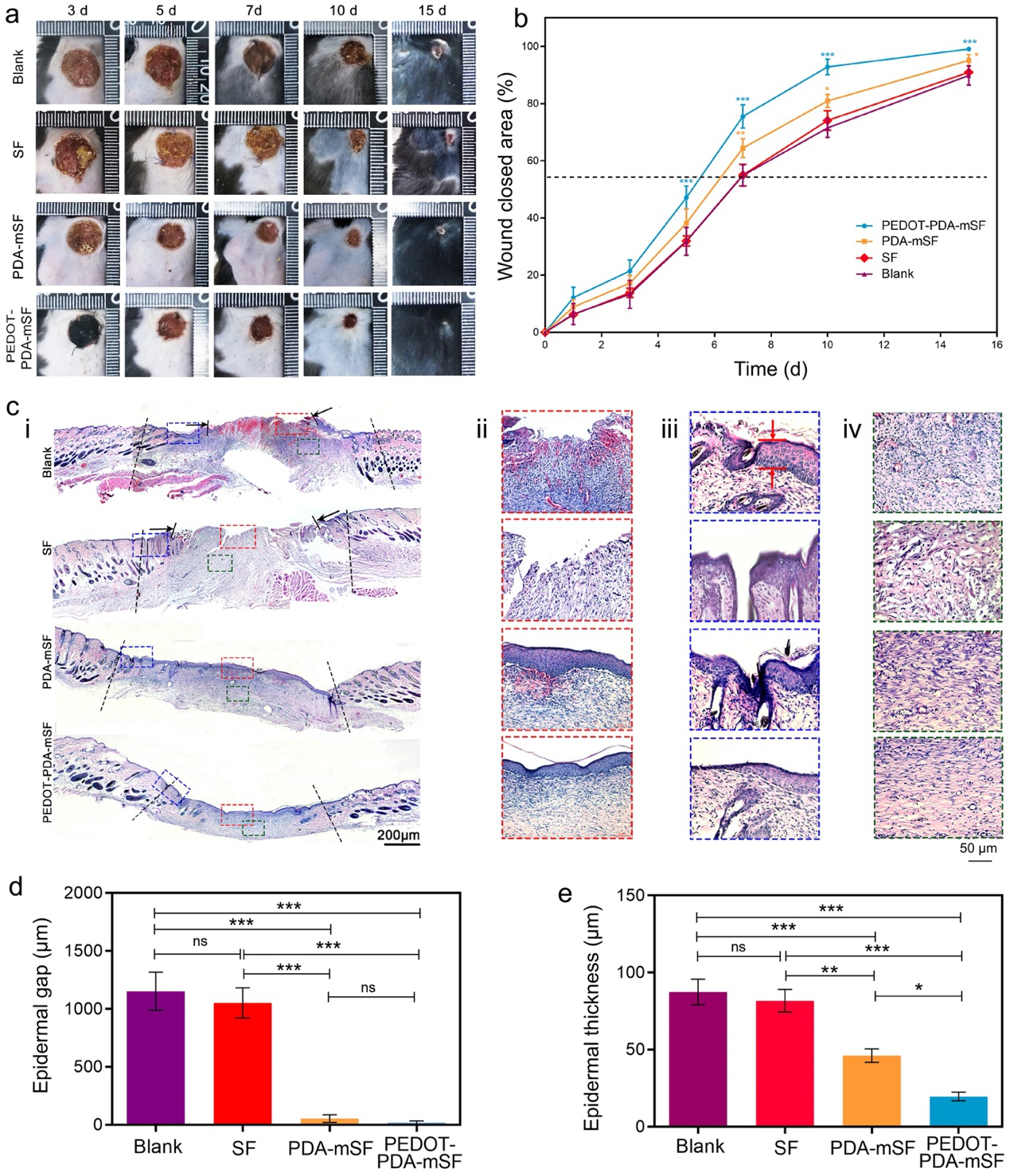
图6. PEDOT-PDA-mSF纤维贴片加速糖尿病伤口愈合。(a)不同贴片处理后伤口愈合照片;(b)不同贴片处理后伤口愈合率;(c)处理15天后,伤口部位切片H&E染色;(d)处理15天后,不同组的伤口宽度对比;(e)处理15天后,不同组的新生表皮组织厚度对比。

图7. PEDOT-PDA-mSF纤维贴片减少糖尿病伤口炎症因子表达和氧化应激。(a)不同组的TNF-α表达;(b)不同组的IL-6 表达;(c)IL-6的免疫荧光染色;(d)不同组的MDA等级;(e)不同组的SOD活性;(f)不同组的MMP-2和MMP-9表达。
该工作以Bioinspired Conductive Silk Microfiber Integrated Bioelectronic for Diagnosis and Wound Healing in Diabetes为题目发表于《Advanced Functional Materials》。论文共同第一作者为西南交通大学材料学院博士生贾占荣、硕士生曾炎和四川大学华西口腔医学院硕士生巩靖蕾。西南交通大学鲁雄教授、谢超鸣副教授和四川大学华西口腔医院王军教授为共同通讯作者。四川大学华西医院刘瑾副教授为论文的共同作者。
论文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/adfm.202010461
- 香港理工大学方波团队《Adv. Mater.》综述:导电高分子纤维研究进展与展望 2025-07-25
- 兰州理工大学冉奋教授团队 Nat. Commun.:肝素掺杂导电聚合物 2024-12-07
- 西南交大鲁雄/中国海大韩璐/北京基础医学研究所江小霞等Nano Today:导电粘附水凝胶调控创伤性脑损伤后的神经炎症与神经功能 2023-07-23
- 陕科大王学川/党旭岗、温州医科大郑漫辉 AFM:可注射自修复生物质基水凝胶生物粘合剂用于伤口愈合和可穿戴生物电子一体化 2026-01-30
- 西安交大郭保林教授团队 Adv. Mater.:自适应伤口敷料用于伤口愈合与修复 2025-12-25
- 西南大学Kang En-Tang/徐立群/鲁志松 AFM:伤口渗出液响应和促感染性伤口愈合的多层纤维敷料 2025-08-16
