2019年11月1日,Nano Letters杂志以“Cancer-Cell-Membrane-Coated Nanoparticles with a Yolk-Shell Structure Augment Cancer Chemotherapy”为题,在线报道了中科院上海药物研究所的最新研究成果。
疾病治疗中,仅依赖药物分子在体内的自由扩散会导致药物体内分布不均且产生的疗效十分有限,需要借助载体才能实现高效输运。对于肿瘤治疗而言,载药纳米粒的体内输运过程十分复杂,若想到达靶部位实现良好的抗肿瘤效果,必须克服体内一系列生理屏障,包括血液循环、肿瘤部位蓄积、肿瘤组织穿透、癌细胞摄取以及细胞内药物释放等。同时也应注意到现阶段很多化疗药物都是基因毒性药物,需要到达细胞内的特定细胞器——细胞核才能发挥治疗作用。因此,将药物高效递送至细胞核对于提高基因毒性化疗药物的治疗效果至关重要。
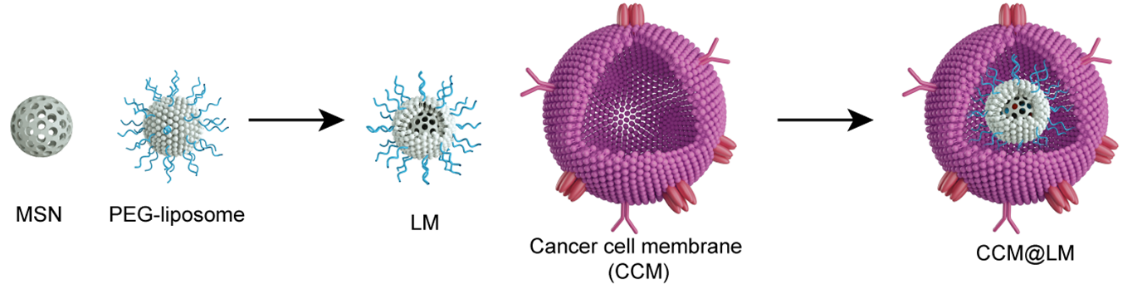
图1. 癌细胞膜包被的蛋黄壳纳米载体的制备示意图。
针对克服肿瘤递药的多重生理屏障,前期研究中,中国科学院上海药物研究所甘勇研究员及合作团队结合超高分辨显微镜和分子动力学模拟技术,发现刚度适中的纳米粒具有适宜的形变能力,易于形变为棒状或椭球状,有利于穿越肿瘤间质生物凝胶,提高递药效率。

图2. 蛋黄壳载体在肿瘤间质中的运动(A)、FRET效应验证其膜融合入胞(B)、快速的胞内转运(C)、载体的细胞内定位(D)以及所载药物(阿霉素)的细胞内定位(E)。
启发于包膜病毒可与宿主细胞发生膜融合,释放内部核衣壳结构进入细胞质并最终锚定在核孔周围释放核酸分子进入细胞核的高效侵袭途径,科研人员在现有的癌细胞包被型载体的基础上进行了载体结构的创新,设计了一种癌细胞膜包被的蛋黄壳纳米载体,并包载基因毒性药物阿霉素和中科院上海药物研究所自主研制的PARP抑制剂美呋派瑞(mefuparib hydrochloride,抑制基因修复)。研究发现该载体具有一般癌细胞包裹纳米载体所共有的免疫逃逸和肿瘤靶向作用,同时适中的刚性使其在肿瘤间质中可形变为椭球状从而加速其在肿瘤组织内的穿透。值得注意的是,该蛋黄壳载体还可模拟包膜病毒的侵袭途径,即通过膜融合入胞,释放内部核心进入细胞质,该“蛋黄”可在胞浆中快速运动并聚集于核周,实现药物高效协同入核,最终提高抗肿瘤效果。这些发现将有助于科学家们进一步开发能够克服递药多重屏障的高效药物载体。
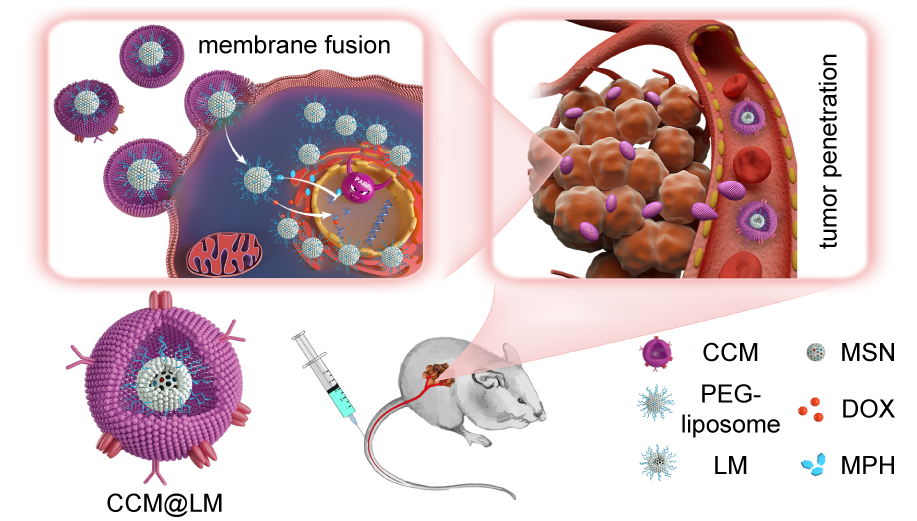
图3. 蛋黄壳载体克服肿瘤递药多重生理屏障的体内转运过程。
该研究工作是在甘勇研究员的指导下,由研究生聂迪、代卓和上海中医药大学本科生李佳霖等人协作完成,同时也得到了国家自然科学基金和中科院战略性先导科技专项的资助。
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
- 福大林立森/新国大陈小元 Nature大子刊:当手性水凝胶遇上细胞膜仿生-可术后空腔植入的生物杂化水凝胶如何调节肿瘤干细胞信号 2025-12-30
- 苏州大学冯良珠教授、刘庄教授团队 AFM:温敏催化水凝胶助力酶触“破膜+氧化应激”级联肿瘤消融新策略 2025-12-04
- 武汉大学张先正教授团队《Nano Lett.》:双管齐下的微生物凝胶递送NO和O?促进糖尿病伤口愈合 2023-06-22
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
- 东南大学葛丽芹教授与合作者 Research:微气泡为模板的免疫活性金属多酚胶囊用于药物递送和增强的肿瘤免疫治疗 2025-07-31
- 四川大学丁明明教授团队 Angew: 可视化β折叠到β转角构象转变的荧光聚合物囊泡及其用于颜色报告型药物递送 2025-07-11
