化疗是目前治疗癌症最有效的手段之一,许多化疗药物(如阿霉素、顺铂和喜树碱等)的主要作用部位是细胞核。然而,在耐药癌细胞质膜和核膜上存在的药物外排转运体(DETs)会减少化疗药物在细胞中的摄取量,并导致化疗药物难以进入细胞核,这是化疗失败的主要原因之一。尽管有一些方法可以增加细胞对化疗药物的摄取,但是目前仍缺乏一种可以在耐药细胞中同时实现细胞质和细胞核药物递送的可靠方法。
受到“特洛伊木马”的启发,东南大学生物科学与医学工程学院、生物电子学国家重点实验室吴富根教授课题组与美国密歇根大学陈战教授合作,采用之前合成的超亮绿色荧光有机硅点(OSiNDs,荧光量子产率:~100%。相关工作发表于:Nano Lett. 2018, 18, 1159)与嵌段高分子(聚乙二醇-聚谷氨酸钠,PEG-PLE)及吲哚菁绿(ICG)组装,形成了可光控释放药物的仿“特洛伊木马”纳米胶(SiPING)。该工作以常用的化疗药物阿霉素(Dox)为模型,将其包裹在纳米胶中。结果证实,包裹在纳米胶中的Dox不仅可以逃过细胞质膜上DETs的外排作用,同时在光照后也可以躲避核膜上的DETs,从而进入细胞核发挥药效,有效对抗了肿瘤细胞的耐药性(如图1所示)。

图1 SiPING像“特洛伊木马”一样,可以越过细胞质膜上的DETs,将药物分子Dox递送到细胞中,然后光控释放药物,实现细胞核的药物递送,从而克服癌细胞的耐药性。
如图2所示,所合成SiPING光照前是39 nm左右的球型结构,因为含有OSiNDs,所以具有很强的绿色荧光。光照后,由于ICG降解,导致SiPING会变成12 nm左右的小颗粒,同时可以快速且大量释放药物分子Dox。由于所含ICG的量较低,所以低浓度下,SiPING不会引起溶液温度升高,也不会产生很多的单线态氧。
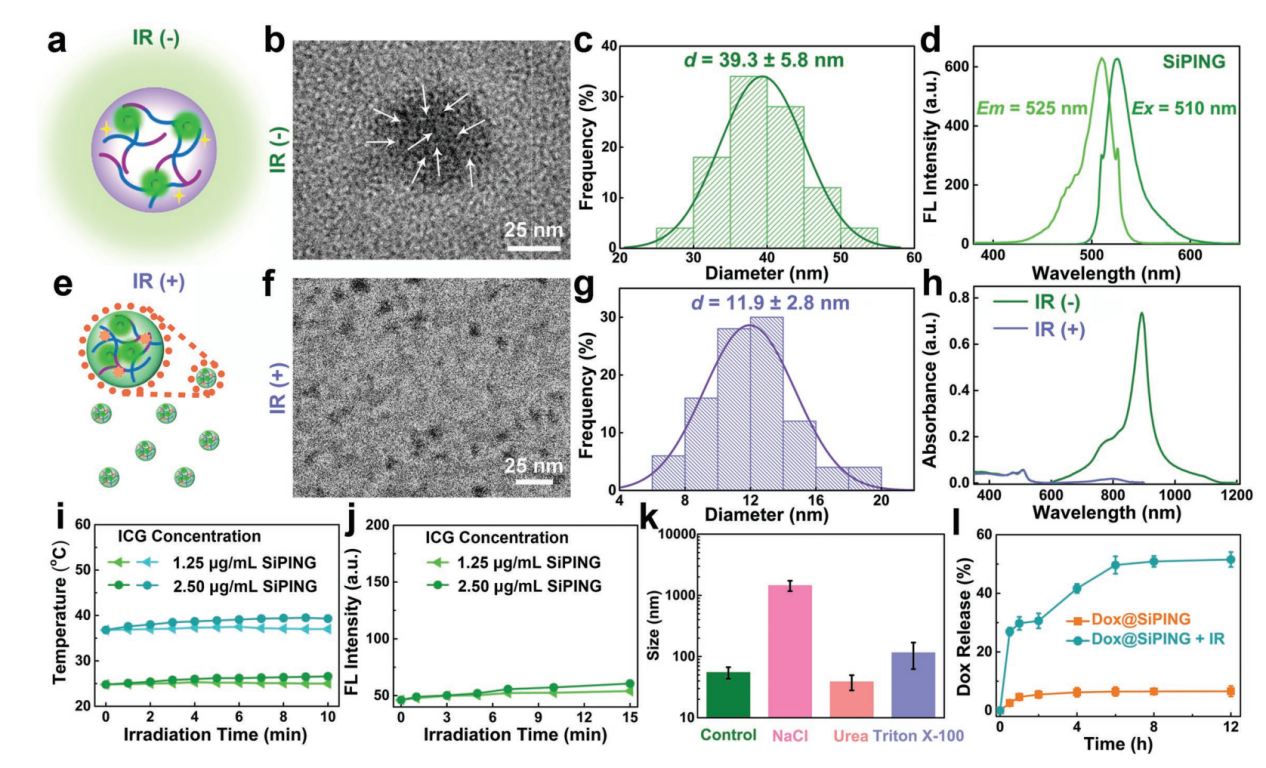
图2(a)SiPING光照前的示意图。(b)SiPING的透射电子显微镜图,白色箭头指向纳米胶中所含的OSiNDs。(c)SiPING的粒径分布统计图。(d)SiPING的荧光激发和发射光谱图。(e)SiPING光照后的示意图。(f)SiPING光照后的透射电子显微镜图。(g)SiPING光照后的粒径分布统计图。(h)SiPING光照前后的吸收光谱图。图中“IR”为光照。(i)SiPING的升温曲线。(j)SiPING的单线态氧产生能力。(k)SiPING的组装机制。(l)光照前后Dox从Dox@SiPING中释放的动力学。
如图3所示,不同于游离Dox,包裹在纳米胶中的Dox可以躲避细胞膜上的DETs,通过内吞进入细胞,实现了在耐药癌细胞中的大量富集。被内吞的Dox@SiPING分布在细胞质中,并且其药物释放速率缓慢,Dox不会富集在细胞核内,所以光照前对细胞的毒性很低。光照后,SiPING粒径变小,同时,大量的Dox快速地从纳米胶中释放出来。尽管细胞核膜上也有DETs,但是Dox仍然进入了细胞核,这可能是如下原因造成的:(1)光照触发Dox分子释放的数量多,速度快,超过了细胞核上DETs外排药物的能力;(2)光照时,纳米胶中的ICG可能产生局部热,并引起局部活性氧水平升高,这可能减弱细胞核上药物外排转运体外排药物的能力。最后,Dox到达了细胞核,与DNA、RNA作用,实现了对耐药癌细胞的有效杀伤。
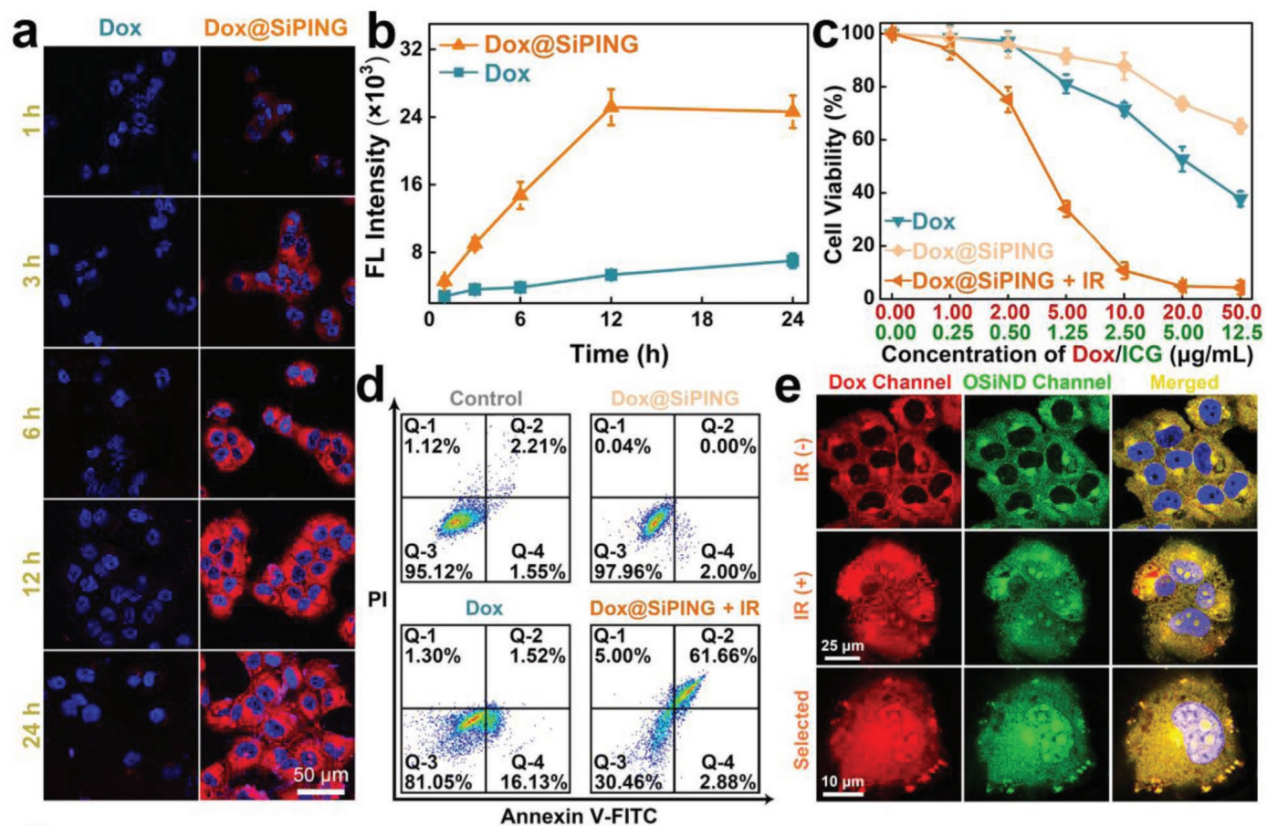
图3 (a)经过不同药物处理后的MCF-7/ADR细胞的荧光共聚焦显微图。(b)经过不同药物处理后的MCF-7/ADR细胞的流式细胞术统计结果。(c)不同药物处理对MCF-7/ADR细胞活力的影响。(d)不同药物处理对MCF-7/ADR细胞凋亡水平的影响。(e)Dox@SiPING处理过的MCF-7/ADR细胞光照前后的共聚焦显微图。
如图4所示,Dox@SiPING在体内具有良好的肿瘤靶向性。光照后,具有较好的抗癌效果,同时具有良好的生物安全性。

图4 (a)荷瘤小鼠尾静脉注射Dox或Dox@SiPINGs不同时间后的体内荧光图。(b)图a中肿瘤区域(白圈标记的位置)Dox通道荧光强度统计结果。(c)小鼠主要器官和肿瘤区域的药物分布。(d)图c中各器官和肿瘤区域荧光强度统计结果。(e)不经或经不同药物处理后的肿瘤的生长曲线。(f)不经或经不同药物处理后,小鼠体重变化曲线。(g)不经或经不同药物处理后小鼠存活率统计结果。(h)肿瘤切片H&E染色照片。
相关研究成果以题为“Smart Supramolecular “Trojan Horse”-Inspired Nanogels for Realizing Light-Triggered Nuclear Drug Influx in Drug-Resistant Cancer Cells”在线发表在Advanced Functional Materials上,并被选为封面文章。东南大学的博士生陈晓凯和张晓东为该论文的共同第一作者,东南大学的吴富根教授和美国密歇根大学的陈战教授为该论文的共同通讯作者,东南大学为第一完成单位。该工作得到了国家自然科学基金、江苏省自然科学基金和东南大学研究生院科研基金等项目的大力支持。
吴富根教授及其相关工作成果简介:吴富根在清华大学化学系获得学士(2006年)和博士(2011年)学位,在美国密歇根大学从事博士后训练(2011-2013年)。2013年2月加入东南大学生物科学与医学工程学院(同年4月被评为教授,同年12月被评为博士生导师)。课题组主要从事亚细胞成像及诊疗,生化检测,以及纳米药物等相关研究。目前总共发表SCI论文110篇,其中以第一/通讯作者发表J. Am. Chem. Soc., Nano Lett., Adv. Funct. Mater., Biomaterials, Small和J. Control. Release等论文75篇(其中影响因子大于7的30余篇)。
论文连接:https://onlinelibrary.wiley.com/doi/full/10.1002/adfm.201807772
- 山东大学崔基炜教授/山西大学冯丽恒教授 ACS Nano:硬度可调的超分子纳米胶囊用于NIR-II荧光成像引导的细菌感染治疗 2026-02-11
- 常州大学王建浩教授团队《Acta Biomater.》:药物储库型聚合物纳米胶束用于肿瘤长效治疗的研究成果 2025-07-08
- 东华大学史向阳教授团队 AFM:微流控合成无载体全活性的金属酚纳米胶囊用于肿瘤的化疗-化学动力学治疗-免疫治疗 2024-12-02
- 福建师大杨震/张先增、西工大黄维 Adv. Sci.:极化调控与界面缺陷工程协同增强光-热释电效应 - 助力肿瘤治疗 2026-03-01
- 天工大高辉/余云健团队 ACS Nano:创新纳米酶精准消除肿瘤胞内菌 助力结直肠癌免疫治疗突破 2026-02-20
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
- 华东理工刘润辉教授课题组 JACS:化疗药物与膜裂解抗肿瘤β-多肽聚合物的协同组合可逆转肿瘤耐药性 2024-04-12
